Nikkelfluoride (NiF2) is een chemische verbinding. Het is samengesteld uit nikkel- en fluoratomen. Gebruikt in verschillende toepassingen, waaronder batterijen en galvaniseren vanwege zijn unieke eigenschappen.
| IUPAC-naam | Nikkel(II)fluoride |
| Moleculaire formule | NiF2 |
| CAS-nummer | 10028-18-9 |
| Synoniemen | Nikkeldifluoride, nikkelfluoride, difluornikkel |
| InChi | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
Eigenschappen van nikkelfluoride
Nikkelfluoride-formule
De chemische formule voor nikkeldifluoride is NiF2. Dit betekent dat elk nikkeldifluoridemolecuul bestaat uit één nikkelatoom en twee aan elkaar gebonden fluoratomen.
Nikkelfluoride Molaire massa
Nikkeldifluoride heeft een molaire massa van ongeveer 96,69 gram per mol. Deze waarde wordt berekend door de atoommassa’s van één nikkelatoom (58,69 g/mol) en twee fluoratomen (elk 18,998 g/mol) op te tellen.
Kookpunt van nikkelfluoride
Het kookpunt van nikkeldifluoride is relatief hoog, ongeveer 1.568 graden Celsius (2.854 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop nikkeldifluoride verandert van de vloeibare fase naar een gasvormige toestand.
Nikkelfluoride Smeltpunt
Nikkeldifluoride heeft een smeltpunt van ongeveer 1.372 graden Celsius (2.502 graden Fahrenheit). Dit is de temperatuur waarbij vast nikkeldifluoride vloeibaar wordt.
Dichtheid van nikkelfluoride g/ml
De dichtheid van nikkeldifluoride is ongeveer 4,72 gram per kubieke centimeter (g/cm³). Deze dichtheidswaarde geeft een overzicht van de dichtheid van deeltjes in een bepaald volume van de stof.
Nikkelfluoride Molecuulgewicht
Het molecuulgewicht van nikkeldifluoride is ongeveer 96,69 gram per mol. Het wordt bepaald door de atoomgewichten van de samenstellende elementen toe te voegen aan de chemische formule NiF2.
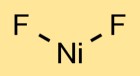
Structuur van nikkelfluoride
Nikkeldifluoride heeft een kristallijne structuur. Het nikkelatoom bevindt zich in het midden, gebonden aan twee fluoratomen. Door de rangschikking van de atomen ontstaat een zich herhalend patroon, dat een kristalrooster vormt.
Oplosbaarheid van nikkelfluoride
Nikkeldifluoride is slecht oplosbaar in water. De oplosbaarheid wordt beïnvloed door factoren zoals temperatuur en de aanwezigheid van andere stoffen. Wanneer het oplost, dissocieert het in Ni+2- en F–ionen in de waterige oplossing.
| Verschijning | Groene kristallijne vaste stof |
| Soortelijk gewicht | 4,72 g/cm³ |
| Kleur | Groente |
| Geur | Geurloos |
| Molaire massa | 96,69 g/mol |
| Dikte | 4,72 g/cm³ |
| Fusie punt | 1372°C (2502°F) |
| Kookpunt | 1.568°C (2.854°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Lost op in water en dissocieert in nikkelionen en fluoride-ionen |
| Dampdruk | Niet goed gedefinieerd |
| Dampdichtheid | Niet goed gedefinieerd |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van nikkelfluoride
Nikkeldifluoride brengt potentiële veiligheidsrisico’s met zich mee. Het kan bij contact huid- en oogirritatie veroorzaken. Inademing van het stof of de dampen ervan kan irritatie van de luchtwegen veroorzaken. Langdurige blootstelling kan leiden tot ernstiger gevolgen voor de gezondheid. Bij het hanteren van nikkeldifluoride moeten passende beschermende maatregelen worden genomen, waaronder handschoenen en een veiligheidsbril. Werkruimtes moeten goed geventileerd zijn om het risico op inademing te minimaliseren. Bij inslikken of accidenteel contact is medische hulp noodzakelijk. Er moet ook rekening worden gehouden met de potentiële gevolgen voor het milieu van nikkeldifluoride, en de verwijdering ervan moet volgens de juiste regelgeving plaatsvinden om besmetting te voorkomen.
| Gevarensymbolen | Gezondheidsrisico |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Schadelijk bij inademing of inslikken. Langdurige blootstelling kan ernstigere gevolgen voor de gezondheid veroorzaken. Hanteer met geschikte beschermende uitrusting. Vermijd inademing en contact. |
| VN-identificatienummers | Niet toegeschreven |
| HS-code | 2826.20.1000 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Matig giftig |
Methoden voor de synthese van nikkelfluoride
Nikkeldifluoride kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak omvat de reactie tussen nikkeloxide (NiO) of nikkelcarbonaat (NiCO3) met fluorwaterstofzuur (HF):
- Reactie met fluorwaterstofzuur :
- Nikkeloxide (NiO) methode: NiO + 2 HF → NiF2 + H2O
- Nikkelcarbonaat (NiCO3) Methode: NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
Een andere methode maakt gebruik van de reactie tussen nikkelchloride (NiCl2) en ammoniumfluoride (NH4F):
- Reactie met ammoniumfluoride : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
Bovendien kan nikkeldifluoride worden verkregen door de reactie van nikkeloxide met ammoniumfluoride:
- Reactie met ammoniumfluoride (nikkeloxidemethode) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
Deze methoden vinden over het algemeen plaats bij gecontroleerde temperaturen en omstandigheden om een goede synthese en productzuiverheid te garanderen. Het is essentieel om voorzichtig om te gaan met fluorwaterstofzuur en andere reagentia vanwege de potentiële gevaren ervan. Het resulterende nikkeldifluoride kan worden gezuiverd en verwerkt voor verschillende toepassingen, zoals batterijmaterialen en galvaniseren.
Gebruik van nikkelfluoride
Nikkeldifluoride (NiF2) vindt vanwege zijn unieke eigenschappen diverse toepassingen. Het dient in verschillende industrieën voor verschillende doeleinden:
- Batterijtechnologie: gebruikt als onderdeel van lithium-ionbatterijen, waardoor hun prestaties en stabiliteit worden verbeterd.
- Galvaniseren: Gebruikt bij galvaniseerprocessen om duurzame, corrosiebestendige nikkelcoatings op verschillende materialen te creëren.
- Katalyse: Werkt als katalysator bij bepaalde chemische reacties en helpt bij de synthese van waardevolle producten.
- Glas en keramiek: opgenomen in de productie van speciaal glas en keramiek, waardoor hun eigenschappen en kenmerken worden verbeterd.
- Fluoridering: Gebruikt voor waterfluoridering om de tandgezondheid te verbeteren door tandbederf te voorkomen.
- Chemische productie: Dient als voorloper bij de synthese van andere nikkelverbindingen en chemicaliën.
- Keramische condensatoren: aanwezig bij de vervaardiging van keramische condensatoren die worden gebruikt in de elektronica en telecommunicatie.
- Farmaceutische producten: gebruikt als reagentia in bepaalde farmaceutische processen en onderzoek.
- Fotografie: Historisch gebruikt in de fotografische industrie als onderdeel van bepaalde fotografische ontwikkelaars.
- Metaallegeringsadditief: toegevoegd aan bepaalde metaallegeringen om hun eigenschappen, zoals sterkte en taaiheid, te verbeteren.
De aanpasbare eigenschappen van nikkeldifluoride maken het tot een waardevolle hulpbron in een breed scala van industrieën, en dragen bij aan de vooruitgang op het gebied van technologie, gezondheidszorg en productie.
Vragen:
Vraag: Wat zijn de producten aan de twee elektroden tijdens de elektrolyse van een NiF2(aq)-oplossing?
A: Aan de kathode wordt metallisch nikkel (Ni) gevormd, terwijl aan de anode fluorgas (F2) vrijkomt.
Vraag: Wat produceert NiF2-elektrolyse?
A: Metallisch nikkel wordt geproduceerd aan de kathode en er ontstaat fluorgas aan de anode tijdens de elektrolyse van NiF2.
Vraag: De verbinding NiF2 is een ionische verbinding. Uit welke ionen bestaat het?
A: NiF2 is samengesteld uit nikkelionen (Ni²⁺) en F-ionen.
Vraag: Welk type reactie is Ni(s) + F2 -> NiF2(s)?
A: De reactie Ni(s) + F2 → NiF2(s) is een combinatiereactie (synthese).
Vraag: Wat is de naam van de verbinding met de formule NiF2?
A: De verbinding met de formule NiF2 wordt nikkel(II)difluoride genoemd.
Vraag: Waar wordt nikkel(II)fluoride gebruikt?
A: Nikkel(II)difluoride wordt gebruikt in batterijtechnologie, galvaniseren, katalysatoren en keramische productie.
Vraag: Wat is de formule voor nikkel(II)fluoride?
A: De formule voor nikkel(II)difluoride is NiF2.
Vraag: Neerslaan nikkel(II)fluoride en natriumhydroxide?
A: Ja, ze slaan neer in de vorm van een groene vaste stof, nikkel(II)hydroxide.
Vraag: Geleidt nikkelfluoride elektriciteit?
A: Ja, nikkeldifluoride kan elektriciteit geleiden in gesmolten toestand of opgelost in water.
Vraag: Is gesmolten nikkelfluoride of grafiet beter geleidend?
A: Gesmolten nikkeldifluoride is beter geleidend dan grafiet vanwege zijn ionische aard en mobiele ionen.
