Nikkel(II)chloride, bekend als NiCl2, is een groenachtig gele chemische verbinding. Het wordt vaak gebruikt bij galvaniseren, katalysatoren en als voorloper bij de synthese van andere nikkelverbindingen.
| Naam van IUPAC | Nikkel(II)chloride |
| Moleculaire formule | NiCl2 |
| CAS-nummer | 7718-54-9 |
| Synoniemen | Nikkelchloride, nikkeldichloride, dichloornikkel, nikkelchloride |
| InChi | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Eigenschappen van nikkelchloride
Nikkelchlorideformule
De formule voor nikkeldichloride is NiCl2. Dit geeft aan dat elk nikkeldichloridemolecuul bestaat uit één nikkelatoom gebonden aan twee chlooratomen. Deze chemische formule biedt belangrijke informatie over de samenstelling en verhouding van de elementen die in de verbinding aanwezig zijn.
Nikkelchloride molaire massa
De molaire massa van nikkeldichloride, berekend door de atoommassa’s van de samenstellende elementen op te tellen, bedraagt ongeveer 129,6 gram per mol. Deze waarde is nuttig voor het bepalen van de hoeveelheid nikkeldichloride die in een bepaald monster aanwezig is en voor verschillende stoichiometrische berekeningen.
Kookpunt van nikkelchloride
Nikkeldichloride heeft een kookpunt van ongeveer 1,007 graden Celsius (1,845 graden Fahrenheit). Bij deze temperatuur ondergaat de verbinding een faseovergang van zijn vloeibare toestand naar een gasvormige toestand. Kookpunt is een belangrijke fysische eigenschap die helpt het gedrag van nikkeldichloride bij verhitting te begrijpen.
Smeltpunt van nikkelchloride
Het smeltpunt van nikkeldichloride is ongeveer 1.002 graden Celsius (1.836 graden Fahrenheit). Dit is de temperatuur waarbij de vaste vorm van nikkeldichloride overgaat in de vloeibare toestand. Het smeltpunt is belangrijk voor toepassingen waarbij sprake is van de hantering en verwerking van nikkeldichloride.
Dichtheid van nikkelchloride g/ml
De dichtheid van nikkeldichloride is ongeveer 3,55 gram per milliliter. Dichtheid is een maatstaf voor de massa per volume-eenheid van een stof en geeft informatie over de compactheid van het materiaal. De dichtheid van nikkeldichloride helpt bij het bepalen van het gedrag ervan in verschillende toepassingen en in verschillende fysieke toestanden.
Nikkelchloride Molecuulgewicht
Het molecuulgewicht van nikkeldichloride is ongeveer 129,6 gram per mol. Het wordt berekend door de atoommassa’s van nikkel en chloor in de verbinding op te tellen. Het molecuulgewicht is essentieel voor het begrijpen van de relaties tussen massa, mol en aantal deeltjes in chemische reacties.
Structuur van nikkelchloride
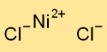
Nikkeldichloride neemt in zijn vaste vorm een kristalroosterstructuur aan. Het bestaat uit afwisselend gerangschikte nikkelkationen (Ni2+) en chloride-anionen (Cl-). Deze opstelling vormt een driedimensionaal netwerk dat bijdraagt aan de stabiliteit en fysische eigenschappen van nikkeldichloride.
Oplosbaarheid van nikkelchloride
Nikkeldichloride heeft een matige oplosbaarheid in water. Het kan oplossen en een groenachtig gele oplossing vormen. De oplosbaarheid van nikkeldichloride wordt beïnvloed door factoren zoals temperatuur en de aanwezigheid van andere stoffen. Het begrijpen van de oplosbaarheid ervan is belangrijk bij verschillende industriële processen en chemische toepassingen waarbij nikkeldichloride betrokken is.
| Verschijning | Groenachtig gele vaste stof |
| Soortelijk gewicht | 3,55 g/ml |
| Kleur | groenachtig geel |
| Geur | Geurloos |
| Molaire massa | 129,6 g/mol |
| Dikte | 3,55 g/ml |
| Fusie punt | 1002°C (1836°F) |
| Kookpunt | 1007°C (1845°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Gematigd |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen (ethanol, aceton) en zuren |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Zuur (ongeveer 4) |
Nikkelchlorideveiligheid en gevaren
Nikkeldichloride brengt bepaalde veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het is belangrijk om voorzichtig met dit middel om te gaan om mogelijke risico’s te voorkomen. Nikkeldichloride kan huidirritatie en sensibilisatie veroorzaken, dus draag handschoenen en beschermende kleding bij het hanteren ervan. Inademing van nikkeldichloridestof of -damp moet worden vermeden, aangezien dit irritatie van de luchtwegen kan veroorzaken. Inslikken van nikkeldichloride kan schadelijk zijn en moet worden vermeden. Bovendien is nikkeldichloride giftig voor in het water levende organismen en kan het milieuschade veroorzaken als het in waterlichamen terechtkomt. De juiste procedures voor opslag, hantering en verwijdering moeten worden gevolgd om de risico’s die verband houden met nikkeldichloride te minimaliseren.
| Gevarensymbolen | Bijtend, schadelijk, gevaar voor het milieu |
| Beveiligingsbeschrijving | – Draag handschoenen en beschermende kleding – Vermijd inademing van stof of damp – Voorkom inslikken – Op de juiste manier opslaan, hanteren en afvoeren |
| Identificatiegegevens van de Verenigde Naties | UN3288 |
| HS-code | 2827.39.80 |
| Gevarenklasse | 8 (corrosief) |
| Verpakkingsgroep | III |
| Toxiciteit | Schadelijk bij inslikken, veroorzaakt huid- en oogirritatie |
Nikkelchloridesynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van nikkeldichloride, elk met zijn eigen voordelen en toepassingen.
Een gebruikelijke methode omvat de reactie van metallisch nikkel of nikkeloxide met zoutzuur. Bij dit proces wordt metallisch nikkel of nikkeloxide aan een geschikte houder toegevoegd en geroerd terwijl langzaam zoutzuur wordt toegevoegd. De reactie tussen nikkel en zuur produceert nikkeldichloride en het vrijkomen van waterstofgas.
Een andere synthesemethode omvat de reactie tussen nikkelcarbonaat en zoutzuur. Zoutzuur lost nikkelcarbonaat op en de verwarmde oplossing ondergaat een reactie waarbij nikkeldichloride wordt gevormd en kooldioxidegas vrijkomt.
Zoutzuur ondergaat een reactie met opgelost nikkelhydroxide wanneer de oplossing wordt verwarmd of met rust wordt gelaten, wat resulteert in de synthese van nikkeldichloride. De reactie leidt tot de vorming van nikkeldichloride en water.
Bovendien kan nikkeldichloride worden bereid door metallisch nikkel te laten reageren met chloorgas. Deze directe reactie tussen de twee elementen levert nikkeldichloride op.
Deze synthesemethoden bieden verschillende routes voor het verkrijgen van nikkeldichloride, waardoor flexibiliteit mogelijk is op het gebied van grondstoffen en reactieomstandigheden. De keuze voor de werkwijze is afhankelijk van factoren als de gewenste zuiverheid van het eindproduct, beschikbaarheid van grondstoffen en specifieke toepassingseisen.
Gebruik van nikkelchloride
Nikkeldichloride heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de opmerkelijke toepassingen:
- Galvaniseren: Bij galvaniseerprocessen wordt doorgaans nikkeldichloride gebruikt om een beschermende en decoratieve coating op verschillende oppervlakken aan te brengen. Nikkeldichloride verbetert het uiterlijk van metalen zoals staal, messing en koper en biedt tegelijkertijd corrosieweerstand.
- Katalysator: Nikkeldichloride fungeert als katalysator bij veel chemische reacties, waaronder hydrogenerings- en polymerisatieprocessen. Het vergemakkelijkt de omzetting van reactanten in gewenste producten en vindt toepassing bij de productie van farmaceutische producten, kunststoffen en synthetische vezels.
- Chemische synthese: Nikkeldichloride dient als voorloper bij de synthese van verschillende nikkelverbindingen, zoals nikkeloxide, nikkelsulfide en nikkelcyanide. Industrieën gebruiken deze verbindingen in katalysatoren, pigmenten, keramiek en magnetische materialen.
- Batterijen: Oplaadbare batterijen, vooral nikkel-metaalhydride (NiMH) batterijen, gebruiken nikkeldichloride als elektrolyt. Het maakt de circulatie van ionen tussen de elektroden mogelijk tijdens laad- en ontlaadcycli.
- Gaszuivering: Industrieën gebruiken nikkeldichloride in gaszuiveringsprocessen om onzuiverheden zoals waterstofsulfide en koolmonoxide te verwijderen. Het vindt toepassingen in de raffinage van aardgas en de petrochemische verwerking.
- Diervoedersupplement: Veevoer, met name pluimvee- en varkensvoer, bevat nikkeldichloride als voedingssupplement. Het vergemakkelijkt de enzymactiviteit en draagt bij aan de algehele gezondheid en groei van dieren.
- Laboratoriumonderzoek: Onderzoekers gebruiken nikkeldichloride in verschillende laboratoriumexperimenten, waaronder in door nikkel gekatalyseerde reacties en als bron van nikkelionen voor chemische analyse.
Deze uiteenlopende toepassingen demonstreren de veelzijdigheid en het belang van nikkeldichloride in sectoren variërend van productie en energie tot landbouw en onderzoek.
Vragen:
Vraag: Welke ionen zijn aanwezig in een waterige oplossing van NiCl2?
A: In een waterige oplossing van NiCl2 zijn de aanwezige ionen Ni2+ (nikkelkation) en Cl- (chloride-anion).
Vraag: Is NiCl2 oplosbaar in water?
A: Ja, NiCl2 is oplosbaar in water en vormt een groenachtig gele waterige oplossing.
Vraag: Welk metaal reageert spontaan met NiCl2(aq)?
A: Metalen zoals magnesium (Mg) en zink (Zn) reageren spontaan met NiCl2(aq) om nikkel te verdringen en hun respectievelijke chloriden te vormen.
Vraag: Is NiCl2 polair of niet-polair?
A: NiCl2 is een polaire verbinding vanwege het verschil in elektronegativiteit tussen nikkel en chloor, wat resulteert in een ongelijke verdeling van de lading.
Vraag: Is NiCl2 waterig?
A: Ja, NiCl2 kan in waterige toestand voorkomen als het in water wordt opgelost, waardoor een waterige oplossing ontstaat.
Vraag: Wat is de naam van de verbinding met de formule NiCl2?
A: De verbinding met de formule NiCl2 wordt nikkel(II)chloride genoemd.
Vraag: Hoe zou u 1,00 liter van een 0,50 M NiCl2-oplossing bereiden?
A: Om een 0,50 M oplossing van NiCl2 te bereiden, lost u 129,6 gram NiCl2 op in water en brengt u het volume op 1,00 L.
Vraag: Wat is het onoplosbare zout dat wordt gevormd tussen een oplossing van Na2S en NiCl2?
A: Wanneer een oplossing van Na2S wordt gemengd met NiCl2, wordt onoplosbaar nikkelsulfide (NiS) gevormd.
Vraag: Is NiCl2(aq) een vaste stof?
A: Nee, NiCl2(aq) verwijst naar een waterige oplossing van NiCl2, wat aangeeft dat het in vloeibare vorm is.
Vraag: Wat maakt kristallijn nikkel(II)chloride groen?
A: De groene kleur van kristallijn nikkel(II)chloride wordt toegeschreven aan de aanwezigheid van nikkel(Ni2+)-kationen in het kristalrooster.
Vraag: Is nikkeldichloride giftig?
A: Ja, nikkeldichloride is giftig en moet met voorzichtigheid worden behandeld. Het kan huidirritatie en ademhalingsproblemen veroorzaken en is schadelijk bij inslikken.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van NiCl2 en Na2S worden gecombineerd?
A: Ja, er treedt een reactie op wanneer waterige oplossingen van NiCl2 en Na2S worden gecombineerd, wat resulteert in de vorming van onoplosbaar nikkelsulfide (NiS) en oplosbaar natriumchloride (NaCl).
Vraag: Hoeveel gram NiCl2 is nodig om 75,0 ml 0,555 M lithiumhydroxide te neutraliseren?
A: Er is ongeveer 18,4 gram NiCl2 nodig om 75,0 ml 0,555 M lithiumhydroxide in een stoichiometrische reactie te neutraliseren.
Vraag: Wat gebeurt er als je ammoniumcarbonaat, nikkeldichloride en water mengt?
A: Wanneer ammoniumcarbonaat, nikkeldichloride en water worden gemengd, vindt er een reactie plaats die resulteert in de vorming van ammoniumchloride, nikkelcarbonaat en water.
