Nikkelcarbonaat (NiCO3) wordt gevormd uit nikkelionen en carbonaationen. Het is een groene vaste stof die vanwege zijn unieke eigenschappen wordt gebruikt in keramiek en katalysatoren.
| IUPAC-naam | Nikkel(II)carbonaat |
| Moleculaire formule | NiCO3 |
| CAS-nummer | 3333-67-3 |
| Synoniemen | Nikkelcarbonaat; Koolzuur, nikkelzout, nikkelmonocarbonaat |
| InChi | InChI=1S/CH2O3.Ni/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Eigenschappen van nikkelcarbonaat
Nikkelcarbonaatformule
De chemische formule voor nikkelmonocarbonaat is NiCO3. Het bestaat uit één nikkelatoom (Ni), één koolstofatoom (C) en drie zuurstofatomen (O).
Nikkelcarbonaat Molaire massa
De molaire massa van nikkelmonocarbonaat (NiCO3) is ongeveer 118,7 gram per mol. Deze waarde wordt verkregen door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen.
Kookpunt van nikkelcarbonaat
Nikkelmonocarbonaat heeft geen duidelijk kookpunt omdat het de neiging heeft te ontleden voordat het het kookpunt bereikt. Bij verhitting valt het uiteen in nikkeloxide, kooldioxide en zuurstof.
Smeltpunt van nikkelcarbonaat
Nikkelmonocarbonaat heeft een smeltpunt van ongeveer 200°C (392°F). Bij deze temperatuur verandert het van vaste naar vloeibare toestand.
Dichtheid van nikkelcarbonaat g/ml
De dichtheid van nikkelmonocarbonaat is ongeveer 3,6 gram per kubieke centimeter (g/cm³). Deze dichtheidswaarde geeft de massa van de verbinding per volume-eenheid aan.
Nikkelcarbonaat Molecuulgewicht
Het molecuulgewicht van nikkelmonocarbonaat (NiCO3) is ongeveer 118,7 gram per mol. Het wordt berekend door de atoomgewichten van de samenstellende atomen op te tellen.
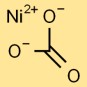
Structuur van nikkelcarbonaat
Nikkelmonocarbonaat heeft een basisstructuur waarin een centraal nikkelatoom in een driehoekige opstelling aan drie zuurstofatomen is gebonden. Dit vormt de kern van het carbonaation. De structuur wordt bij elkaar gehouden door ionische en covalente bindingen.
Oplosbaarheid van nikkelcarbonaat
Nikkelmonocarbonaat is slecht oplosbaar in water. De oplosbaarheid ervan neemt toe naarmate de pH van de oplossing afneemt. Het kan ook oplossen in zure oplossingen die stoffen zoals zoutzuur bevatten.
De eigenschappen van nikkelmonocarbonaat maken het bruikbaar in een verscheidenheid aan toepassingen. Door de onoplosbaarheid in water is het geschikt voor toepassingen in keramiek en pigmenten. De ontleding ervan bij hoge temperaturen draagt bij aan het gebruik ervan in katalytische processen.
| Verschijning | Stevig groen |
| Soortelijk gewicht | 3,6 g/cm³ |
| Kleur | Groente |
| Geur | Geurloos |
| Molaire massa | 118,7 g/mol |
| Dikte | 3,6 g/cm³ |
| Fusie punt | 200°C (392°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in zuren zoals zoutzuur |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van nikkelcarbonaat
Nikkelmonocarbonaat brengt potentiële veiligheidsrisico’s met zich mee. Het kan bij contact de huid en ogen irriteren en roodheid en ongemak veroorzaken. Inademing van stof of dampen kan irritatie van de luchtwegen of hoesten veroorzaken. Het is raadzaam er voorzichtig mee om te gaan en geschikte beschermende uitrusting te dragen, zoals handschoenen en een bril. Vermijd het innemen of inhaleren van de verbinding. Bij blootstelling de getroffen gebieden wassen en medische hulp inroepen als de symptomen aanhouden. Adequate ventilatie- en inperkingsmaatregelen zijn essentieel om de risico’s te minimaliseren. Het volgen van veiligheidsprotocollen bij het werken met nikkelmonocarbonaat is van cruciaal belang om mogelijke gezondheidsproblemen te voorkomen en een veilige omgeving te garanderen.
| Gevarensymbolen | Irriterend, gevaar voor de gezondheid |
| Beveiligingsbeschrijving | Irriterend; Vermijd contact en inademing; Breekbaar |
| VN-identificatienummers | Niet toegeschreven |
| HS-code | 2836.40.00 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet geclassificeerd |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken; irritatie van de luchtwegen bij inademing |
Nikkelcarbonaatsynthesemethoden
Nikkelmonocarbonaat kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke benadering omvat de reactie tussen een oplosbaar nikkelzout (zoals nikkelchloride of nikkelsulfaat ) en een oplosbaar carbonaatzout (zoals natriumcarbonaat) in water. De twee oplossingen worden gemengd, wat leidt tot de vorming van onoplosbaar nikkelmonocarbonaat in de vorm van een groen neerslag. Dit neerslag wordt vervolgens gefiltreerd, gewassen en gedroogd om het eindproduct te verkrijgen.
Een andere methode omvat de reactie tussen nikkeloxide of nikkelhydroxide en kooldioxidegas in aanwezigheid van vocht. Dit resulteert in de vorming van nikkelmonocarbonaat met water. Dit proces wordt vaak industrieel gebruikt om nikkelmonocarbonaat te produceren.
Bovendien kan een precipitatieproces worden gebruikt door een oplossing van een oplosbaar nikkelzout te mengen met een oplossing van een oplosbaar carbonaatzout. Het resulterende mengsel wordt geroerd en het gevormde nikkelmonocarbonaatneerslag wordt verzameld en behandeld.
Deze synthesemethoden produceren nikkelmonocarbonaat voor verschillende toepassingen zoals keramiek, katalysatoren en pigmenten. Zorgvuldige controle van de reactieomstandigheden en zuiveringsstappen is cruciaal om hoogwaardige nikkelmonocarbonaatproducten te verkrijgen.
Gebruik van nikkelcarbonaat
Nikkelmonocarbonaat vindt verschillende toepassingen vanwege zijn unieke eigenschappen. Enkele belangrijke toepassingen zijn onder meer:
- Keramiek- en glasproductie: Nikkelmonocarbonaat verbetert keramiek en glas met levendige kleuren voor artistieke expressie en industrieel gebruik.
- Katalysator: Het dient als katalysator of katalysatorvoorloper in verschillende chemische processen en vergemakkelijkt oxidatiereacties door het vrijkomen van zuurstof tijdens ontleding bij hoge temperaturen.
- Galvaniseren: Het gebruik van nikkelmonocarbonaat als voorloper maakt het galvaniseren van nikkel op verschillende oppervlakken mogelijk, waardoor het uiterlijk van het oppervlak en de corrosieweerstand worden verbeterd.
- Batterij-industrie: Bij batterijtechnologieën, vooral die op basis van nikkel, draagt het bij aan kathodematerialen, waardoor de vooruitgang van batterijsystemen wordt ondersteund.
- Pigmenten en inkten: Nikkelmonocarbonaat is een integraal onderdeel van de productie van een spectrum aan groene tinten in pigmenten, inkten en verven.
- Landbouw: De toepassing ervan als bron van voedingsnikkel in meststoffen komt de plantengroei ten goede en wordt in de landbouw gebruikt.
- Geneeskunde: Hoewel zeldzaam, onderzoeken onderzoekers potentiële medische toepassingen vanwege bepaalde nikkelverbindingen, met name nikkelmonocarbonaat, die antimicrobiële eigenschappen aantonen.
- Fotografie: Historisch gezien heeft het een rol gespeeld in toners voor zwart-witfotografie, waarbij tinten en contrasten werden verrijkt.
- Textiel: De textielindustrie gebruikt nikkelmonocarbonaat om de opname van kleurstoffen te verbeteren en kleur in stoffen te brengen.
- Onderzoek en onderwijs: De chemische eigenschappen van nikkelmonocarbonaat bevestigen het belang ervan in scheikundige laboratoria voor educatieve demonstraties, experimenten en onderzoek.
Deze veelzijdige toepassingen tonen het belang aan van nikkelmonocarbonaat in verschillende industrieën, van het verbeteren van de esthetiek van keramiek tot het spelen van een rol in geavanceerde technologieën zoals batterijen en katalysatoren.
Vragen:
Vraag: Welk element is het meest reactief?
EEN: Natrium.
Vraag: Welk bruikbaar materiaal wordt gemaakt door ijzer te mengen met chroom, koolstof en nikkel?
EEN: Roestvrij staal.
Vraag: Is nikkelcarbonaat oplosbaar in water?
A: Niet erg oplosbaar.
Vraag: Hoeveel mol koolstof zit er in nikkeltetracarbonyl?
A: Vier moedervlekken.
Vraag: Hoe verwijder ik vernikkeling van koolstofstaal?
A: Gebruik van geschikte chemische stripmiddelen of elektrochemische methoden.
Vraag: Netto ionische vergelijking van nikkel (II) nitraat en natriumcarbonaat?
A: Ni²⁺ + CO₃²⁻ → NiCO₃(s).
Vraag: Rol van koolmonoxide bij de nikkelextractie?
A: Het werkt als een reductiemiddel om nikkel uit de ertsen te extraheren.
Vraag: Oplosbaarheid van nikkelmonocarbonaat?
A: Lage oplosbaarheid in water.
Vraag: Atoomnummers van koolstof, natrium en nikkel?
A: Koolstof: 6, Natrium: 11, Nikkel: 28.
Vraag: Wat gebeurt er als je ammoniumcarbonaat, nikkelchloride en water mengt?
A: Vorming van nikkelmonocarbonaatneerslag en vrijkomen van ammoniumchloridegas.
