Nikkelacetaat, met de formule Ni(CH3COO)2, is een chemische verbinding. Het wordt gebruikt in verschillende industrieën, waaronder galvaniseren en katalysatorsynthese, vanwege de nikkel- en acetaatcomponenten.
| IUPAC-naam | Nikkelacetaat |
| Moleculaire formule | Ni(CH3COO)2 |
| CAS-nummer | 373-02-4 |
| Synoniemen | Nikkelzout van azijnzuur, nikkeldiacetaat, nikkelacetaat |
| InChi | InChI=1S/2C2H4O2.Ni/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van nikkelacetaat
Nikkelacetaatformule
De chemische formule voor nikkeldiacetaat is Ni(CH3COO)2. Dit betekent dat elk nikkeldiacetaatmolecuul één Ni-atoom gebonden aan twee CH3COO-ionen bevat.
Nikkelacetaat molaire massa
De molaire massa van nikkeldiacetaat is ongeveer 176,7 g/mol. Deze waarde wordt berekend door de atoommassa’s van één nikkelatoom en vier zuurstofatomen van acetaationen op te tellen.
Kookpunt van nikkelacetaat
Nikkeldiacetaat heeft een kookpunt van ongeveer 140°C (284°F). Bij deze temperatuur verandert de verbinding van zijn vloeibare toestand naar een gasvormige toestand.
Smeltpunt van nikkelacetaat
Het smeltpunt van nikkeldiacetaat is ongeveer 140°C (284°F). Dit is de temperatuur waarbij de vaste verbinding in een vloeistof verandert.
Dichtheid van nikkelacetaat g/ml
Nikkeldiacetaat heeft een dichtheid van ongeveer 1,744 g/ml. Deze dichtheidswaarde vertegenwoordigt de massa van de verbinding per volume-eenheid en wordt vaak gebruikt om vloeistoffen te karakteriseren.
Nikkelacetaat Molecuulgewicht
Het molecuulgewicht van nikkeldiacetaat, ook wel molecuulgewicht genoemd, is 176,7 g/mol. Deze waarde wordt berekend door de atoomgewichten van alle atomen in de verbinding op te tellen.
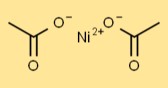
Nikkelacetaatstructuur
De structuur van nikkeldiacetaat omvat een centraal Ni-atoom gebonden aan twee CH3COO-ionen. Acetaationen dragen bij aan de coördinatie rond het nikkelatoom, waardoor het een specifieke geometrie krijgt.
Oplosbaarheid van nikkelacetaat
Nikkeldiacetaat heeft een matige oplosbaarheid in water. Het kan in water oplossen om een oplossing te vormen. De oplosbaarheid kan variëren afhankelijk van de temperatuur en de aanwezigheid van andere stoffen in de oplossing.
| Verschijning | Groen kristallijn poeder |
| Soortelijk gewicht | ~1.744 g/ml |
| Kleur | Groente |
| Geur | Geurloos |
| Molaire massa | ~176,7 g/mol |
| Dikte | ~1.744 g/ml |
| Fusie punt | ~140°C (284°F) |
| Kookpunt | ~140°C (284°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Gematigd |
| Oplosbaarheid | Oplosbaar in diverse oplosmiddelen |
| Dampdruk | Niet goed gedocumenteerd |
| Dampdichtheid | Niet goed gedocumenteerd |
| pKa | Niet goed gedocumenteerd |
| pH | Niet goed gedocumenteerd |
Nikkelacetaatveiligheid en gevaren
Nikkeldiacetaat brengt potentiële veiligheidsrisico’s met zich mee. Het kan de huid, ogen en luchtwegen irriteren bij contact of inademing. Vermijd inname, aangezien dit schadelijke effecten kan veroorzaken. Voldoende ventilatie is noodzakelijk om inademing van de dampen te voorkomen. Draag bij het hanteren geschikte beschermende uitrusting, zoals handschoenen en een veiligheidsbril. Voer het op de juiste manier af en voorkom dat het in het milieu terechtkomt. Bij blootstelling medische hulp inroepen. Volg de veiligheidsinformatiebladen en aanwijzingen bij het gebruik van nikkeldiacetaat om de risico’s die gepaard gaan met de hantering, opslag en verwijdering ervan te minimaliseren.
| Gevarensymbolen | Gezondheidsrisico |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Schadelijk bij inslikken of inademen. Voorkom lozing in het milieu. Draag beschermende uitrusting. Zoek medische hulp bij blootstelling. |
| VN-identificatienummers | UN3077 (Klasse 9) |
| HS-code | 2915.12.00 |
| Gevarenklasse | 9 (Diverse gevaarlijke goederen) |
| Verpakkingsgroep | III |
| Toxiciteit | Matige toxiciteit; kan irritatie en schade veroorzaken bij inslikken, inademen of bij contact met de huid of ogen. |
Methoden voor de synthese van nikkelacetaat
Nikkeldiacetaat kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak is om nikkeloxide (NiO) of nikkelcarbonaat (NiCO3) te laten reageren met azijnzuur (CH3COOH) of zijn derivaten. Deze reactie vindt plaats onder gecontroleerde omstandigheden, resulterend in de vorming van nikkeldiacetaat en water als bijproducten. Een andere methode omvat de behandeling van metallisch nikkel of nikkelhydroxide (Ni(OH)2) met azijnzuur of zouten daarvan, waardoor de vorming van nikkeldiacetaat wordt vergemakkelijkt.
Bovendien kan een precipitatieproces worden gebruikt door een oplosbaar nikkelzout, zoals nikkelchloride (NiCl2), te mengen met een oplosbaar acetaatzout. Dit mengsel zorgt ervoor dat het nikkeldiacetaat uit de oplossing neerslaat, dat vervolgens kan worden gescheiden en verzameld. Zorgvuldige pH-aanpassing tijdens dit proces helpt optimale resultaten te bereiken.
Deze synthesemethoden zijn essentieel voor de productie van nikkeldiacetaat voor verschillende toepassingen, waaronder het gebruik ervan als katalysator en voorloper in chemische reacties. De keuze voor de methode hangt af van factoren als de gewenste zuiverheid, efficiëntie en schaal van productie.
Gebruik van nikkelacetaat
Nikkeldiacetaat vindt veelzijdige toepassingen in verschillende industrieën vanwege de verschillende eigenschappen en chemische samenstelling. Enkele belangrijke toepassingen zijn onder meer:
- Galvaniseren: Nikkeldiacetaat dient als bron van nikkelionen bij galvaniseerprocessen. Het vergemakkelijkt de afzetting van een dunne laag nikkel op verschillende substraten, waardoor de corrosieweerstand wordt verbeterd en een decoratieve afwerking wordt verkregen.
- Katalysatorsynthese: Chemici gebruiken het als een voorloper om katalysatoren te creëren voor meerdere chemische reacties. Industrieën als de petrochemie en de farmaceutische industrie zijn sterk afhankelijk van nikkelhoudende katalysatoren.
- Textielindustrie: Bij het verven van textiel helpt het om kleurstoffen op textielvezels te fixeren, de hechting van kleurstoffen en de kleurvastheid te verbeteren.
- Laboratoriumreagens: Wetenschappers gebruiken nikkeldiacetaat als reagens om bepaalde verbindingen te detecteren en identificeren, waardoor ze kunnen testen op specifieke functionele groepen.
- Oppervlaktebehandeling: Fabrikanten passen het toe in oppervlaktebehandelingstoepassingen, zoals de productie van printplaten. Het helpt bij het vormen van een beschermende laag op koperen oppervlakken.
- Organische synthese: Bij verschillende organische synthesereacties speelt nikkeldiacetaat een cruciale rol bij de vorming van koolstof-koolstof- en koolstof-heteroatoombindingen.
- Gaszuivering: Het speelt een sleutelrol in gaszuiveringsprocessen, vooral bij de verwijdering van onzuiverheden zoals waterstofsulfide uit industriële gassen.
- Analytische chemie: Nikkeldiacetaat is een standaardreagens in de analytische chemie, gebruikt voor kalibratie- en kwaliteitscontroledoeleinden.
Over het geheel genomen benadrukken de uiteenlopende toepassingen van nikkeldiacetaat het belang ervan in alle sectoren, van het verbeteren van de productesthetiek tot het ondersteunen van kritische chemische transformaties en processen.
Vragen:
Vraag: Kun je acetaal en nikkel in één lus mengen?
A: Het mengen van acetaal en nikkel in een gesp wordt over het algemeen niet aanbevolen, omdat acetaal kan reageren met bepaalde metalen, waardoor mogelijk corrosie en schade aan de onderdelen van de gesp kan ontstaan.
Vraag: Wat is de juiste formule voor de ionische verbinding nikkelacetaat?
A: De juiste formule voor nikkeldiacetaat, een ionische verbinding, is Ni(CH3COO)2.
Vraag: Hebben nikkel(ii)-acetaat + ijzer(ii)bromide een empirische formule?
A: Nikkel(II)diacetaat en ijzer(II)bromide vormen geen directe verbinding, dus een empirische formule is niet van toepassing.
Vraag: Wat is een acetaal-nikkel-waterblok?
A: Een acetaal-nikkel-waterblok verwijst naar een koelcomponent die wordt gebruikt in pc-vloeistofkoelsystemen, meestal gemaakt van acetaalplastic en met een vernikkeld oppervlak.
Vraag: Wat zijn de reactiesnelheden van nikkel en koper met azijnzuur?
A: Nikkel en koper reageren langzaam met azijnzuur, waarbij waterstofgas vrijkomt en hun respectievelijke diacetaatzouten worden gevormd.
Vraag: Hoe kan nikkelacetaat worden gemaakt?
A: Nikkeldiacetaat kan worden gemaakt door nikkeloxide of nikkelcarbonaat te laten reageren met azijnzuur, gevolgd door kristallisatie en zuivering.
Vraag: Hoe nikkelacetaat verwijderen?
A: Voer nikkeldiacetaat af als gevaarlijk afval in overeenstemming met de plaatselijke regelgeving. Het is belangrijk om de afvalbeheerautoriteiten te raadplegen voor geschikte verwijderingsmethoden.
Vraag: Wat is de formule voor nikkel(ii)-acetaat?
A: De formule voor nikkel(II)diacetaat is Ni(CH3COO)2.
Vraag: Is nikkelacetaat oplosbaar?
A: Ja, nikkeldiacetaat is matig oplosbaar in water en vormt een oplossing die voor verschillende toepassingen kan worden gebruikt.
