Natriumzinkaat is een chemische verbinding met de formule Na2Zn(OH)4. Het is een wit vast poeder dat wordt gebruikt als voorloper bij de synthese van zinkoxide-nanodeeltjes en als reagens in de organische chemie.
| IUPAC-naam | Natriumzinkaat |
| Moleculaire formule | Na2Zn(OH)4 |
| CAS-nummer | 12179-14-5 |
| Synoniemen | Natriumzinkhydroxide, natriumzinkaat, dinatriumtetrahydroxyzinkaat, zink, tetrahydroxide |
| InChi | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Natriumzinkaatformule
De chemische formule voor natriumzinkaat is Na2Zn(OH)4, wat aangeeft dat het twee natriumionen (Na+) en één zinkoxide-ion (ZnO2-) bevat. De formule wordt gebruikt om de samenstelling van de verbinding weer te geven en kan worden gebruikt om de molaire massa, het molecuulgewicht en andere eigenschappen van de verbinding te berekenen. De formule kan ook worden gebruikt om chemische vergelijkingen te schrijven en de producten te voorspellen van reacties waarbij natriumzinkaat betrokken is.
Molaire massa natriumzinkaat:
De molaire massa van natriumzinkaat wordt berekend door de atoommassa’s van alle elementen die aanwezig zijn in één mol van de verbinding op te tellen. Voor natriumzinkaat (Na2Zn(OH)4) bedraagt de molaire massa ongeveer 179,42 g/mol. Deze waarde kan nuttig zijn bij het bepalen van de hoeveelheid natriumzinkaat die nodig is om een specifieke hoeveelheid oplossing te bereiden of bij het bepalen van de massa van de verbinding in een bepaald monster.
Kookpunt van natriumzinkaat:
Na2Zn(OH)4 is een vaste stof en heeft geen kookpunt. Het ontleedt echter bij hoge temperaturen en de resulterende gassen kunnen kookpunten hebben, afhankelijk van hun samenstelling. Daarom is het kookpunt van Na2Zn(OH)4 geen relevante eigenschap.
Dichtheid van natriumzinkaat g/ml:
De dichtheid van Na2Zn(OH)4 bedraagt ongeveer 2,7 g/cm³. Deze waarde kan nuttig zijn voor het bepalen van de massa van een specifiek volume Na2Zn(OH)4 of voor het bepalen van het volume van een specifieke massa natriumzinkaat. De dichtheid hangt af van temperatuur en druk en kan variëren afhankelijk van de specifieke omstandigheden van het experiment.
Molecuulgewicht van natriumzinkaat:
Het molecuulgewicht van Na2Zn(OH)4 wordt berekend door de atoomgewichten van alle atomen in het molecuul op te tellen. Natriumzinkaat heeft een molecuulgewicht van ongeveer 179,42 g/mol. Het molecuulgewicht is een belangrijke eigenschap omdat het wordt gebruikt bij berekeningen met betrekking tot de hoeveelheid natriumzinkaat die nodig is voor een reactie of formulering.
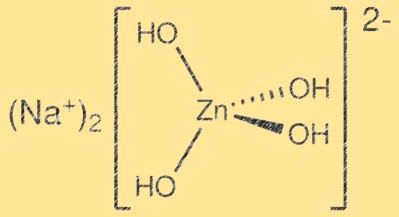
Structuur van natriumzinkaat:
Na2Zn(OH)4 heeft een complexe kristalstructuur met lagen ZnO4-tetraëders en Na2O6-octaëders. ZnO4-tetraëders delen hoeken en vormen een driedimensionaal rooster, terwijl Na2O6-octaëders de interstitiële ruimtes innemen. De resulterende structuur is gelaagd en kan worden omschreven als een afgeleide van de wurtzietstructuur. De lagen worden bij elkaar gehouden door Van der Waals-krachten en de resulterende kristalstructuur is relatief zwak.
| Verschijning | Wit vast poeder |
| Soortelijk gewicht | 2,7 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 179,42 g/mol |
| Dikte | 2,7 g/cm³ |
| Fusie punt | N.v.t |
| Kookpunt | N.v.t |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in organische oplosmiddelen |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | Alkalisch (pH > 7) |
Merk op dat sommige eigenschappen, zoals vlampunt en dampdruk, niet relevant zijn voor natriumzinkaat omdat het een vaste verbinding is.
Veiligheid en gevaren van natriumzinkaat
Na2Zn(OH)4 brengt bepaalde veiligheids- en gevarenrisico’s met zich mee waarmee rekening moet worden gehouden bij het hanteren van de verbinding. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en een veiligheidsbril, bij het hanteren van Na2Zn(OH)4. De verbinding kan huid- en oogirritatie veroorzaken en inslikken kan leiden tot maag-darmklachten. Na2Zn(OH)4 kan ook brandgevaar opleveren en moet op een koele, droge plaats worden bewaard, uit de buurt van hitte en ontstekingsbronnen. Een juiste behandeling en opslag van Na2Zn(OH)4 kan de risico’s die aan de verbinding verbonden zijn, helpen minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S22: Stof niet inademen. S24/25: Vermijd contact met huid en ogen. S37/39: Draag geschikte handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2834.29 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | De exacte toxiciteit van natriumzinkaat is niet goed gekarakteriseerd, maar het kan huid- en oogirritatie veroorzaken en kan schadelijk zijn bij inslikken. Het is belangrijk om voorzichtig met het mengsel om te gaan en geschikte persoonlijke beschermingsmiddelen te dragen. |
Methoden voor de synthese van natriumzinkaat
Er zijn verschillende methoden die je kunt gebruiken om Na2Zn(OH)4 te synthetiseren, maar de meest gebruikelijke methode is het mengen van zinkoxide en natriumhydroxide in een waterige oplossing. Eerst moet je zinkoxide mengen met natriumhydroxide in een waterige oplossing. Verwarm en roer het mengsel vervolgens totdat er een heldere oplossing ontstaat. Zodra de oplossing is afgekoeld, zal Na2Zn(OH)4 uit de oplossing neerslaan, die met water moet worden gewassen en gedroogd om het eindproduct te verkrijgen.
Een andere manier om Na2Zn(OH)4 te synthetiseren is door zink toe te voegen aan een oplossing van natriumhydroxide en het mengsel te verwarmen totdat er een heldere oplossing ontstaat. Zodra de oplossing is afgekoeld, zal Na2Zn(OH)4 uit de oplossing neerslaan, die met water moet worden gewassen en gedroogd om het eindproduct te verkrijgen.
Het is van cruciaal belang om de synthese van Na2Zn(OH)4 uit te voeren in een goed geventileerde ruimte en om geschikte persoonlijke beschermingsmiddelen te dragen. Voorzichtigheid is ook geboden bij het hanteren van natriumhydroxide, aangezien het bijtend kan zijn en irritatie aan de huid en ogen kan veroorzaken.
Gebruik van natriumzinkaat
Diverse industrieën gebruiken Na2Zn(OH)4 voor meerdere doeleinden. Een van de belangrijkste toepassingen is als voorloper voor de synthese van zinkoxide, dat fabrikanten gebruiken bij de productie van rubber, keramiek en andere producten. Na2Zn(OH)4 werkt als stabilisator bij de productie van synthetische vezels en kunststoffen.
In de agrarische sector gebruiken boeren Na2Zn(OH)4 als meststof om planten te voorzien van essentiële voedingsstoffen zoals zink. Het kan gewassen ook beschermen tegen schimmelziekten en dient als fungicide.
Fabrikanten van pigmenten, zoals zinkgeel, gebruiken bij hun productie Na2Zn(OH)4, dat veel wordt gebruikt in verven en coatings. Bovendien gebruiken industrieën Na2Zn(OH)4 als corrosieremmer om metalen tegen corrosie te beschermen.
In de farmaceutische industrie dient Na2Zn(OH)4 als bron van zink, een essentiële voedingsstof voor de menselijke gezondheid. Zink is een essentieel element in verschillende biologische processen en speelt een essentiële rol bij het behouden van een gezond immuunsysteem en het bevorderen van wondgenezing.
Over het geheel genomen heeft Na2Zn(OH)4 een reeks belangrijke toepassingen in verschillende industrieën en is het een veelzijdige verbinding met veel potentiële toepassingen.
Vragen:
Is natriumzinkaat een zout?
Natriumzinkaat wordt als een zout beschouwd omdat het een ionische verbinding vormt door de reactie van een metaal (zink) en een base (natriumhydroxide). Elektrostatische krachten houden de positief geladen zinkionen en de negatief geladen natrium- en hydroxide-ionen bij elkaar. Zouten zijn ionische verbindingen die worden gevormd door de reactie tussen een zuur en een base of een metaal en een niet-metaal. Hoewel Na2Zn(OH)4 niet het resultaat is van de reactie van een zuur en een base, voldoet het toch aan de algemene definitie van een zout als een ionische verbinding.
