Natriumthiosulfaat is een chemische verbinding met de formule Na2S2O3. Het wordt vaak gebruikt als fixeermiddel bij fotografische verwerking en als reductiemiddel bij bepaalde chemische reacties.
| IUPAC-naam | Natriumthiosulfaat |
| Moleculaire formule | Na2S2O3 |
| CAS-nummer | 7772-98-7 |
| Synoniemen | Natriumhyposulfiet, natriumthiosulfaat, dinatriumzout van thiozwavelzuur, natriumthiosulfaatpentahydraat |
| InChi | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschappen van natriumthiosulfaat
Natriumthiosulfaatformule
De chemische formule voor natriumthiosulfaat is Na2S2O3. Het bestaat uit twee Na+-ionen en twee S2O3 2–ionen. De formule toont de typen en het aantal atomen die aanwezig zijn in een molecuul van de verbinding.
Natriumthiosulfaat molaire massa
De molmassa van Na2S2O3 bedraagt 158,11 g/mol. Het wordt berekend door de atoommassa’s van alle atomen die in één mol van de verbinding aanwezig zijn, bij elkaar op te tellen. Deze waarde is handig voor het bepalen van de hoeveelheid Na2S2O3 die nodig is voor een specifieke reactie of voor het berekenen van de concentratie van een oplossing.
Kookpunt van natriumthiosulfaat
Na2S2O3 heeft geen kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij normale druk ontleedt het tussen 48 en 55°C, waarbij zwaveldioxide vrijkomt. Deze eigenschap maakt het ongeschikt voor toepassingen bij hoge temperaturen.
Natriumthiosulfaat Smeltpunt
Het smeltpunt van Na2S2O3 is 48,3°C. Dit is de temperatuur waarbij de vaste verbinding van toestand verandert in vloeistof. Het smeltpunt is relatief laag in vergelijking met andere anorganische zouten, waardoor het gemakkelijk in water oplost.
Dichtheid van natriumthiosulfaat g/ml
De dichtheid van Na2S2O3 bedraagt 1,667 g/ml. Deze waarde verwijst naar de massa van de stof per volume-eenheid. Het is groter dan de dichtheid van water, wat betekent dat Na2S2O3 in water zinkt.
Natriumthiosulfaat Molecuulgewicht
Het molecuulgewicht van Na2S2O3 bedraagt 158,11 g/mol. Het is de som van de atoomgewichten van alle atomen die aanwezig zijn in een molecuul van de verbinding. Het molecuulgewicht is nuttig voor het bepalen van de hoeveelheid Na2S2O3 die nodig is voor een specifieke reactie of voor het berekenen van de concentratie van een oplossing.
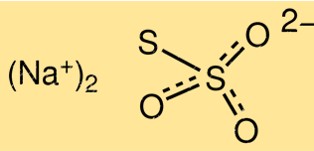
Structuur van natriumthiosulfaat
De structuur van Na2S2O3 bestaat uit twee S2O3 2-ionen, gekoppeld aan een natriumion, Na+. Het molecuul heeft een trigonale piramidevorm met een bindingshoek van ongeveer 103 graden. Het thiosulfaation heeft één zwavel-zwavelbinding en twee zwavel-zuurstofbindingen.
Oplosbaarheid van natriumthiosulfaat
Na2S2O3 is zeer goed oplosbaar in water. De oplosbaarheid van Na2S2O3 in water neemt toe met de temperatuur, waarbij ongeveer 70 g van de verbinding oplost in 100 ml water van 25°C. Het is ook oplosbaar in glycerol en enigszins oplosbaar in alcohol. De oplosbaarheid maakt het nuttig in verschillende toepassingen, zoals fotografische verwerking en medische behandelingen.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1.667 g/ml |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 158,11 g/mol |
| Dikte | 1.667 g/ml |
| Fusie punt | 48,3°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in glycerol en enigszins oplosbaar in alcohol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutraal (pH 7) |
Veiligheid en gevaren van natriumthiosulfaat
Na2S2O3 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld. Het kan echter schadelijk zijn als het wordt ingeslikt, ingeademd of als het in contact komt met de ogen of de huid. De verbinding kan huid- en oogirritatie veroorzaken en langdurige blootstelling kan leiden tot dermatitis. Inslikken van Na2S2O3 kan maagdarmklachten veroorzaken, zoals misselijkheid en braken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en een veiligheidsbril, wanneer u met Na2S2O3 werkt. Indien blootgesteld, moet het getroffen gebied worden gespoeld met water en moet indien nodig medische hulp worden ingeroepen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd contact met ogen, huid en kleding. Niet inslikken. Draag geschikte persoonlijke beschermingsmiddelen. |
| VN-identificatienummers | UN3077 |
| HS-code | 2832.3010.00 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit; De LD50 (oraal, rat) bedraagt 6.200 mg/kg |
Methoden voor de synthese van natriumthiosulfaat
Er zijn verschillende methoden om Na2S2O3 te synthetiseren.
Een gebruikelijke methode is om natriumsulfiet te laten reageren met zwavel in aanwezigheid van een alkalische oplossing. Een andere methode omvat het laten reageren van natriumsulfiet met zwaveldioxide onder druk.
Eén methode om Na2S2O3 te bereiden is door de zwavel op te lossen in een hete oplossing van natriumsulfiet en natriumhydroxide . De oplossing koelt af en iemand filtert het om een vast product te verkrijgen.
Bij deze methode wordt zwaveldioxide gereageerd met natriumhydroxide om natriumsulfiet te produceren, en vervolgens wordt het gereageerd met elementaire zwavel om Na2S2O3 te produceren.
Om Na2S2O3 te produceren, kan zwavelzuur in reactie worden gebracht met natriumsulfiet, vervolgens de resulterende oplossing verwarmen en zwavel toevoegen. Het natriumsulfiet reageert vervolgens met de zwavel en vormt Na2S2O3.
Een andere methode omvat het laten reageren van natriumhydroxide met zwavel, gevolgd door de toevoeging van natriumsulfiet om Na2S2O3 te vormen.
Gebruik van natriumthiosulfaat
Na2S2O3 heeft een breed scala aan toepassingen in verschillende industrieën en toepassingen, waaronder:
- Fotografie: Gebruikt als fixeermiddel om onbelicht zilverhalogenide van fotoafdrukken en films te verwijderen.
- Waterbehandeling: Wordt gebruikt om water te dechloreren door chloor te neutraliseren en de schadelijke effecten ervan op het waterleven te voorkomen.
- Medische toepassingen: Gebruikt bij de behandeling van cyanidevergiftiging omdat het reageert met cyanide en thiocyanaat vormt, dat minder giftig is en uit het lichaam kan worden uitgescheiden.
- Industriële toepassingen: Gebruikt als reductiemiddel in chemische processen en als conserveermiddel in textiel, leer en papier.
- Analytische chemie: gebruikt als titrant bij de analyse van verschillende metalen, zoals koper en arseen.
- Voedings- en drankenindustrie: gebruikt als conserveermiddel voor levensmiddelen om verkleuring te voorkomen en als smaakversterker.
- Tuinbouw: Wordt gebruikt om de effecten van chloor in water dat wordt gebruikt voor de irrigatie van planten te neutraliseren.
Vragen:
Vraag: Waar wordt natriumthiosulfaat voor gebruikt?
A: Na2S2O3 heeft een breed scala aan toepassingen, waaronder fotografie, waterbehandeling, medische behandelingen, industriële processen, analytische chemie, conservering van voedsel en dranken en tuinbouw.
Vraag: Hoe maak je natriumthiosulfaat?
A: Na2S2O3 kan worden gesynthetiseerd door natriumsulfiet te laten reageren met zwavel of zwaveldioxide in aanwezigheid van een alkalische oplossing. Andere methoden omvatten het laten reageren van natriumhydroxide met zwavel of zwaveldioxide om natriumsulfiet te produceren, dat vervolgens reageert met zwavel om Na2S2O3 te produceren.
Vraag: Wat is natriumgoudthiosulfaat?
A: Goud Na2S2O3 is een complexe verbinding die wordt gevormd door de reactie van goudchloride en Na2S2O3. Het wordt gebruikt bij het vergulden en analytische chemie om goud te detecteren en te kwantificeren.
Vraag: Waar kan ik natriumthiosulfaat kopen?
A: Na2S2O3 kan worden gekocht bij chemische leveranciers, laboratoriumleveranciers en online retailers.
Vraag: Waar kan ik natriumthiosulfaat vinden?
A: Na2S2O3 kan worden aangetroffen in een verscheidenheid aan producten, waaronder fotografische chemicaliën, waterbehandelingsproducten en medische behandelingen.
Vraag: Wat is het oxidatiegetal van zwavel in Na2S2O3?
A: Het oxidatiegetal van zwavel in Na2S2O3 is +2 in het thiosulfaation (S2O3^2-) en +6 in het sulfaation (SO4^2-).
Vraag: Hoe kan ik het gewicht van Cu vinden uit de titratie van Na2S2O3?
A: Het gewicht van Cu kan worden berekend op basis van het volume en de molariteit van de Na2S2O3-oplossing die bij de titratie wordt gebruikt, met behulp van de uitgebalanceerde chemische vergelijking voor de reactie tussen Cu en Na2S2O3.
Vraag: Hoe weet je of er een stoichiometrische hoeveelheid Na2S2O3 is toegevoegd?
A: Er is een stoichiometrische hoeveelheid Na2S2O3 toegevoegd wanneer het eindpunt van de reactie is bereikt, zoals aangegeven door een verandering in kleur of andere fysische of chemische eigenschap.
Vraag: Als 5 druppels 0,15 M KI worden toegevoegd aan 40 druppels Na2S2O3, wat is dan de uiteindelijke concentratie KI?
A: De uiteindelijke concentratie van KI kan niet worden bepaald zonder aanvullende informatie, zoals het volume of de concentratie van de Na2S2O3-oplossing.
Vraag: Hoe vind ik de molariteit van Na2S2O3?
A: De molariteit van Na2S2O3 kan worden berekend op basis van de massa van het monster en het volume en de concentratie van de oplossing die wordt gebruikt om het op te lossen, met behulp van de formule Molariteit = mol opgeloste stof/volume oplossing in liters.
