Natriumsulfide (sulfide) is een chemische verbinding met de formule Na2S. Het wordt vaak gebruikt in de papier- en pulpindustrie en bij waterbehandeling om zware metalen te verwijderen.
| IUPAC-naam | Dinatriumsulfide |
| Moleculaire formule | Na2S |
| CAS-nummer | 1313-82-2 |
| Synoniemen | Natriumsulfide, natriummonosulfide, dinatriumsulfide, watervrij natriumsulfide, nonahydraat natriumsulfide, natriumsulfide |
| InChi | InChI=1S/2Na.S/q2*+1;-2 |
Molaire massa natriumsulfide
Natriumsulfide heeft een molaire massa van 78,045 g/mol. Dit betekent dat één mol natriumsulfide 78,045 gram van de verbinding bevat. Molaire massa is een hoeveelheid die nuttig is voor het berekenen van de hoeveelheid van een stof die nodig is voor een reactie, en voor het bepalen van het molecuulgewicht van een verbinding.
Kookpunt van natriumsulfide
Natriumsulfide heeft een relatief hoog kookpunt van >1180°C (2156°F). Dit betekent dat het een aanzienlijke hoeveelheid energie kost om de vaste vorm van natriumsulfide in zijn gasvorm om te zetten. Het hoge kookpunt geeft ook aan dat natriumsulfide een stabiele verbinding is bij hoge temperaturen.
Smeltpunt van natriumsulfide
Natriumsulfide heeft een smeltpunt van 1180°C (2156°F). Dit betekent dat het een aanzienlijke hoeveelheid energie kost om de vaste vorm van natriumsulfide in zijn vloeibare vorm om te zetten. Het hoge smeltpunt van natriumsulfide geeft ook aan dat het een stabiele verbinding is bij hoge temperaturen.
Dichtheid van natriumsulfide g/ml
De dichtheid van natriumsulfide varieert afhankelijk van de vorm. De watervrije vorm van natriumsulfide heeft een dichtheid van 1,856 g/ml, terwijl de nonahydraatvorm een dichtheid heeft van 1,58 g/ml. De dichtheid van een stof is de massa per volume-eenheid en is een bruikbare grootheid voor het bepalen van de concentratie van een oplossing.
Molecuulgewicht van natriumsulfide
Het molecuulgewicht van natriumsulfide is 78,045 g/mol. Dit betekent dat één mol natriumsulfide 6,022 x 10^23 moleculen van de verbinding bevat. Het molecuulgewicht is een hoeveelheid die nuttig is voor het berekenen van de hoeveelheid stof die nodig is voor een reactie, en voor het bepalen van de molaire massa van een verbinding.
Structuur van natriumsulfide
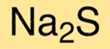
Natriumsulfide heeft een kristallijne structuur in zijn watervrije vorm. De verbinding vormt kleurloze kristallen die zeer oplosbaar zijn in water. De structuur van de verbinding bestaat uit natriumkationen (Na+) en sulfide-anionen (S2-). De verbinding heeft een sterke ionische binding tussen natrium- en sulfide-ionen.
Natriumsulfide-formule
De chemische formule voor natriumsulfide is Na2S. Dit betekent dat elk molecuul natriumsulfide twee natriumkationen en één sulfide-anion bevat. De formule is nuttig om de chemische samenstelling van de verbinding te begrijpen en de eigenschappen ervan te bepalen.
| Verschijning | Geel tot geelbruine vaste stof, vervloeiend |
| Soortelijk gewicht | 1,856 (watervrij), 1,58 (nonahydraat) |
| Kleur | Kleurloos tot geel |
| Geur | De geur van rotte eieren |
| Molaire massa | 78,045 g/mol |
| Dikte | 1,856 g/ml (watervrij), 1,58 g/ml (nonahydraat) |
| Fusie punt | 1180°C (2156°F) |
| Kookpunt | >1180°C (2156°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol, glycerol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch, pH ~12 |
Veiligheid en gevaren van natriumsulfide
Natriumsulfide kan verschillende veiligheidsrisico’s met zich meebrengen. Het is zeer reactief met water en kan bij contact ernstige huid- en oogirritatie veroorzaken. Inademing van de verbinding kan irritatie van de luchtwegen veroorzaken en bij inslikken misselijkheid, braken en diarree veroorzaken. De verbinding is ook licht ontvlambaar en kan heftig reageren met oxidatiemiddelen. Het is belangrijk om voorzichtig met natriumsulfide om te gaan en geschikte beschermende uitrusting te dragen, zoals handschoenen en een veiligheidsbril. Bij het hanteren van het mengsel moet ook voor voldoende ventilatie worden gezorgd. Bij blootstelling moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Bijtend, giftig |
| Beveiligingsbeschrijving | Stof/rook/gas/nevel/damp/spuitnevel niet inademen. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. BIJ CONTACT MET DE OGEN: voorzichtig afspoelen met water gedurende enkele minuten. Verwijder contactlenzen, indien aanwezig en gemakkelijk te doen. Ga door met spoelen. BIJ CONTACT MET DE HUID (of het haar): Verwijder onmiddellijk alle verontreinigde kleding. Huid afspoelen met water/douchen. NA INSLIKKEN: Mond spoelen. GEEN braken opwekken. Bel onmiddellijk een ANTIGIFCENTRUM of een arts. |
| AN-identificaties | VN1849 |
| HS-code | 2830.10.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig; kan bij inslikken ernstige huid- en oogirritatie, irritatie van de luchtwegen, misselijkheid, braken en diarree veroorzaken. Kan dodelijk zijn bij inslikken. |
Methoden voor de synthese van natriumsulfide
Er bestaan verschillende methoden voor het synthetiseren van natriumsulfide:
Een gebruikelijke methode is om natriumhydroxide (NaOH) te laten reageren met zwavel (S) in een hogetemperatuuroven om natriumsulfide (Na2S) en water (H2O) te produceren.
Een andere methode omvat het laten reageren van zwaveldioxide (SO2) met natriumsulfide (Na2S) om natriumthiosulfaat (Na2S2O3) te vormen, en het vervolgens laten reageren met natriumhydroxide (NaOH) om natriumnatriumsulfide (Na2S) en water (H2O) te vormen.
Een derde methode omvat de reductie van natriumsulfaat (Na2SO4) met koolstof in de aanwezigheid van houtskool bij hoge temperaturen om natriumsulfide (Na2S), kooldioxide (CO2) en koolmonoxide (CO) te produceren.
Een andere methode omvat het laten reageren van natriumcarbonaat (Na2CO3) met zwavel (S) in aanwezigheid van houtskool bij hoge temperaturen, waardoor natriumsulfide (Na2S), kooldioxide (CO2) en koolmonoxide worden geproduceerd. koolstof (CO2).
Om natriumsulfide te synthetiseren, kan natriumsulfide-nonahydraat (Na2S.9H2O) worden gereageerd met zwavelzuur (H2SO4) om natriumsulfaat (Na2SO4) en zwaveldioxide (SO2) te produceren. Verwarm vervolgens het natriumsulfaat met houtskool om natriumsulfide (Na2S) en kooldioxide (CO2) te produceren.
Over het algemeen zijn er verschillende methoden voor het synthetiseren van natriumsulfide, en het kiezen van een bepaalde methode hangt af van factoren zoals de gewenste zuiverheid, hoeveelheid en kosteneffectiviteit van het product.
Gebruik van natriumsulfide
Natriumsulfide bedient verschillende industrieën met een breed scala aan toepassingen.
De leerindustrie gebruikt het gewoonlijk als ontharingsmiddel om haar en wol van huiden en vellen te verwijderen.
Het wordt gebruikt als zwavelmiddel om zwavelkleurstoffen voor textiel te produceren en als reductiemiddel bij de vervaardiging van andere chemicaliën zoals natriumhydrosulfiet.
In de pulp- en papierindustrie werkt natriumsulfide als bleekmiddel en helpt het lignine uit houtpulp te verwijderen.
Het wordt ook gebruikt als flotatiemiddel in de mijnbouw om koper-, lood- en zinkertsen van hun ganggesteente te scheiden.
In de afvalwaterzuiveringsindustrie wordt natriumsulfide gebruikt als reductiemiddel om zware metalen uit afvalwaterstromen te verwijderen. Bovendien helpt het als dechloreringsmiddel om achtergebleven chloor in waterbehandelingsprocessen te verwijderen.
De farmaceutische industrie gebruikt natriumsulfide bij de productie van bepaalde medicijnen en als reductiemiddel bij organisch-chemische reacties.
Laboratoria gebruiken het als reagens in de analytische chemie en als bron van zwavelionen bij de chemische synthese.
Over het algemeen is natriumsulfide een veelzijdige verbinding met verschillende toepassingen in verschillende industrieën. De unieke chemische eigenschappen maken het onder meer bruikbaar als reductiemiddel, ontharingsmiddel, flotatiemiddel en dechloreringsmiddel.
Vragen:
Vraag: Wat is de lading van het kation in de ionische verbinding natriumsulfide?
A: Het kation van natriumsulfide is natrium (Na+), dat een lading heeft van +1.
Vraag: Wat is de formule voor natriumsulfide?
A: De formule voor natriumsulfide is Na2S, wat de ionische verbinding vertegenwoordigt die wordt gevormd door de combinatie van een natriumkation (Na+) en een sulfide-anion (S2-).
Vraag: Wat is de formule voor natriumsulfide?
A: De formule voor natriumsulfide is Na2S, wat de ionische verbinding vertegenwoordigt die wordt gevormd door de combinatie van een natriumkation (Na+) en een sulfide-anion (S2-).
Vraag: Is natriumsulfide oplosbaar?
A: Natriumsulfide is oplosbaar in polaire oplosmiddelen zoals water en ethanol, maar het is onoplosbaar in niet-polaire oplosmiddelen zoals benzeen en chloroform.
Vraag: Is natriumsulfide oplosbaar in water?
A: Ja, natriumsulfide is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 50 g/100 ml bij kamertemperatuur. Wanneer natriumsulfide in water wordt opgelost, ondergaat het hydrolyse om natriumhydroxide en waterstofsulfidegas te vormen.
