Natriumperchloraat is een chemische verbinding met de formule NaClO4. Het is een witte kristallijne vaste stof die zeer oplosbaar is in water en vaak wordt gebruikt als oxidatiemiddel in verschillende industriële processen.
| IUPAC-naam | Natriumperchloraat |
| Moleculaire formule | NaClO4 |
| CAS-nummer | 7601-89-0 |
| Synoniemen | Perchloorzuur, natriumzout; Natriumperchloraat (Frans); Natriumperchloraat (Duits); Perclorato di natrium (Italiaans); Perclorato natrium (Spaans); VN 1502 |
| InChi | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Eigenschappen van natriumperchloraat
Natriumperchloraatformule
De chemische formule voor natriumperchloraat is NaClO4. Dit betekent dat de verbinding bestaat uit één natriumatoom, één chlooratoom en vier zuurstofatomen. Natriumperchloraat is een krachtig oxidatiemiddel dat vaak wordt gebruikt in verschillende industriële processen.
Natriumperchloraat Molaire massa
De molaire massa van NaClO4 is 122,44 g/mol. Dit betekent dat één mol NaClO4 122,44 gram van de verbinding bevat. De molaire massa van een verbinding is belangrijk bij het bepalen van de hoeveelheid stof die nodig is voor een chemische reactie.
Kookpunt van natriumperchloraat
Het kookpunt van NaClO4 is 545°C (1013 hPa). Dit is de temperatuur waarbij de verbinding overgaat van vloeistof naar gas. NaClO4 heeft een hoog kookpunt vanwege de sterke elektrostatische krachten tussen natrium- en perchloraationen.
Natriumperchloraat Smeltpunt
Het smeltpunt van NaClO4 is 482°C. Dit is de temperatuur waarbij de verbinding verandert van vaste naar vloeibare toestand. NaClO4 heeft een hoog smeltpunt vanwege de sterke elektrostatische krachten tussen natrium- en perchloraationen.
Dichtheid van natriumperchloraat g/ml
De dichtheid van NaClO4 is 2,52 g/ml. Dit betekent dat één milliliter NaClO4 2,52 gram weegt. De dichtheid van een stof is belangrijk bij het bepalen van de fysieke eigenschappen ervan, zoals drijfvermogen en viscositeit.
Natriumperchloraat Molecuulgewicht
Het molecuulgewicht van NaClO4 is 122,44 g/mol. Dit is de som van de atoomgewichten van de natrium-, chloor- en zuurstofatomen in de verbinding. Het molecuulgewicht van een verbinding is belangrijk bij het bepalen van de fysische en chemische eigenschappen ervan.
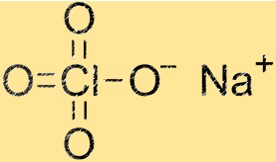
Structuur van natriumperchloraat
De structuur van NaClO4 is een kristalrooster bestaande uit Na+ kationen en ClO4-anionen. Natriumkationen zijn omgeven door vier zuurstofatomen, terwijl ClO4-anionen uit één chlooratoom en vier zuurstofatomen bestaan. De kristalroosterstructuur geeft NaClO4 zijn karakteristieke fysische en chemische eigenschappen.
Oplosbaarheid van natriumperchloraat
NaClO4 is zeer oplosbaar in water, met een oplosbaarheid van 209 g/100 ml bij 20°C. Dit betekent dat in een kleine hoeveelheid water een grote hoeveelheid NaClO4 kan oplossen. De hoge oplosbaarheid van NaClO4 maakt het bruikbaar in diverse industriële processen, zoals de productie van ammoniumperchloraat voor raketbrandstof.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,52 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 122,44 g/mol |
| Dikte | 2,52 g/ml |
| Fusie punt | 482°C |
| Kookpunt | 545°C (1013 hPa) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 209 g/100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in water en ethanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van natriumperchloraat
NaClO4 is een gevaarlijke verbinding waarmee voorzichtig moet worden omgegaan. Het is een sterk oxidatiemiddel dat heftig kan reageren met organische materialen, reductiemiddelen en andere chemicaliën. Blootstelling aan NaClO4-stof of -damp kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Inslikken van NaClO4 kan maag-darmirritatie, misselijkheid en braken veroorzaken. NaClO4 is ook schadelijk voor het waterleven en moet op de juiste manier worden verwijderd. Bij het hanteren van NaClO4 moeten persoonlijke beschermingsmiddelen zoals handschoenen, een veiligheidsbril en een gasmasker worden gedragen om blootstelling te voorkomen. Goede ventilatie en opslag zijn ook belangrijk om het risico op ongevallen te minimaliseren.
| Gevarensymbolen | O, Xn |
| Beveiligingsbeschrijving | Stof/rook/gas/nevel/damp/spuitnevel niet inademen. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. NA INSLIKKEN: Mond spoelen. GEEN braken opwekken. Als u zich onwel voelt, bel dan een ANTIGIFCENTRUM of een arts. |
| VN-identificatienummers | UN1502 |
| HS-code | 2829.90.90 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken, schadelijk bij inademing of bij contact met de huid. Kan irritatie of corrosie veroorzaken. |
Methoden voor de synthese van natriumperchloraat
Er zijn verschillende methoden om NaClO4 te synthetiseren.
Een gebruikelijke methode is de reactie van natriumchloraat met zoutzuur , wat resulteert in de vorming van NaClO4 en natriumchloride .
Een andere methode omvat de elektrolyse van een natriumchlorideoplossing in aanwezigheid van een perchloraatzout. Er vindt omzetting van natriumchloride in natriumchloraat plaats, gevolgd door de toevoeging van zoutzuur, dat het omzet in NaClO4.
Een andere benadering is om natriumchloraat te laten reageren met natriumchloride in aanwezigheid van zwavelzuur. Deze methode produceert een mengsel van NaClO4 en natriumsulfaat, dat kan worden gescheiden door gefractioneerde kristallisatie.
Een andere methode omvat de reactie van natriumchloraat met ammoniumperchloraat, waarbij NaClO4 en ammoniumchloride ontstaan. De productie van NaClO4, dat gewoonlijk wordt gebruikt als oxidatiemiddel in vaste raketbrandstof, omvat het gebruik van deze methode.
De reactie van natriumhypochloriet met natriumchloraat in aanwezigheid van zoutzuur synthetiseert ook NaClO4. Deze methode produceert NaClO4 en natriumchloride als de belangrijkste producten.
Gebruik van natriumperchloraat
NaClO4 heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van NaClO4:
- Raketdrijfgassen: Vaak gebruikt als oxidatiemiddel in vaste raketstuwgassen vanwege hun hoge zuurstofgehalte en hoge stabiliteit.
- Pyrotechniek: Gebruikt als oxidatiemiddel in pyrotechnische samenstellingen zoals fakkels, vuurwerk en fakkels.
- Analytische chemie: gebruikt als bron van perchloraationen in de analytische chemie voor de bepaling van ionen in verschillende monsters.
- Galvaniseren: Gebruikt als component in galvaniseeroplossingen om de geleidbaarheid en stabiliteit van het galvaniseerbad te verbeteren.
- Batterijen: Gebruikt als elektrolyt in lithium-ionbatterijen, vanwege de hoge oplosbaarheid en het vermogen om de elektrochemische eigenschappen van de batterij te verbeteren.
- Medische toepassingen: Gebruikt bij de behandeling van schildklieraandoeningen als competitieve remmer van het jodiumtransport. Wordt ook gebruikt bij de productie van contrastmiddelen voor medische beeldvorming.
- Waterbehandeling: Gebruikt bij waterbehandeling als desinfectiemiddel en om bepaalde verontreinigingen uit water te verwijderen.
Vragen:
Vraag: Wat is de formule voor natriumperchloraat?
A: NaClO4.
Vraag: Is natriumperchloraat oplosbaar in water?
A: Ja, NaClO4 is zeer oplosbaar in water.
Vraag: Is natriumperchloraat een zuur of een base?
A: NaClO4 is noch een zuur, noch een base. Het is zout.
Vraag: Wat is de reactie van ammoniumperchloraat en natriumbromide?
A: De reactie is: NH4ClO4 + NaBr → NaClO4 + NH4Br.
Vraag: Hoeveel natriumionen zitten er in natriumperchloraat?
A: Er zit een natriumion in NaClO4.
Vraag: Is NaClO4 een zuur of een base?
A: NaClO4 is noch een zuur, noch een base. Het is een zout.
Vraag: Welke opgeloste soorten zijn aanwezig in een NaClO4-oplossing?
A: In een NaClO4-oplossing zijn de opgeloste soorten Na+- en ClO4–ionen.
Vraag: Hoeveel mol zuurstof zit er in 3,30 mol NaClO4?
A: Er zitten 13,2 mol zuurstof in 3,30 mol NaClO4.
Vraag: Is NaClO4 oplosbaar in water?
A: Ja, NaClO4 is zeer goed oplosbaar in water.
Vraag: Hoeveel mol zuurstof zit er in 1,10 mol NaClO4?
A: Er zitten 4,4 mol zuurstof in 1,10 mol NaClO4.
