Natriummetabisulfiet (Na2S2O5) is een chemische verbinding die wordt gebruikt als conserveermiddel en antioxidant in voedingsmiddelen en dranken. Het kan ook worden gebruikt als desinfectie- en bleekmiddel in verschillende industrieën.
| IUPAC-naam | Natriumpyrosulfiet |
| Moleculaire formule | Na2S2O5 |
| CAS-nummer | 7681-57-4 |
| Synoniemen | Dinatriumdisulfiet, pyrozwavelzuur, dinatriumzout, natriumpyrosulfiet, natriumdisulfiet |
| InChi | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Eigenschappen van natriummetabisulfiet
Natriummetabisulfietformule
De chemische formule voor natriummetabisulfiet is Na2S2O5. Het bestaat uit twee natriumionen (Na+) en één disulfietion (S2O5-2). De verbinding is een wit of geelachtig kristallijn poeder, oplosbaar in water en verspreidt een scherpe geur.
Natriummetabisulfiet molaire massa
De molaire massa van Na2S2O5 is 190,107 g/mol. Deze waarde wordt berekend door de atoommassa’s van de elementen in de verbinding op te tellen, namelijk 22,99 g/mol voor natrium, 32,06 g/mol voor zwavel en 15,99 g/mol voor zuurstof. Molaire massa is een belangrijke eigenschap die helpt bepalen hoeveel van een stof nodig is voor een chemische reactie.
Kookpunt van natriummetabisulfiet
Na2S2O5 heeft een hoog smeltpunt van 150°C, maar valt uiteen voordat het kan koken. De verbinding valt uiteen in zwaveldioxide (SO2) en natriumsulfiet (Na2SO3) bij een temperatuur van ongeveer 150°C. Daarom is het kookpunt van Na2S2O5 niet van toepassing.
Natriummetabisulfiet Smeltpunt
Het smeltpunt van Na2S2O5 is 150°C. Bij deze temperatuur ondergaat de verbinding een faseverandering van vast naar vloeibaar. Het smeltpunt is een belangrijke fysieke eigenschap die helpt bij het identificeren en karakteriseren van een stof.
Dichtheid van natriummetabisulfiet g/ml
De dichtheid van Na2S2O5 bedraagt 1,48 g/ml. Het is een relatief dichte verbinding die in water zinkt. De dichtheid van een stof is de massa per volume-eenheid en is een belangrijke fysieke eigenschap die helpt bepalen hoeveel van een stof zich in een bepaald volume bevindt.
Natriummetabisulfiet Molecuulgewicht
Het molecuulgewicht van Na2S2O5 is 190,107 g/mol. Het is de som van de atoomgewichten van alle atomen in de verbinding. Het molecuulgewicht is een belangrijke eigenschap die helpt bij het berekenen van de hoeveelheid stof die nodig is voor een chemische reactie.
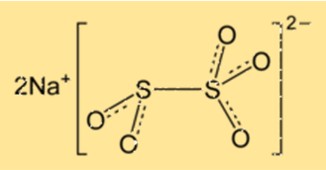
Structuur van natriummetabisulfiet
Na2S2O5 heeft een kristalstructuur en behoort tot het orthorhombische kristalsysteem. Het kristalrooster bestaat uit natriumionen en disulfietionen, gerangschikt in een zich herhalend patroon. De verbinding heeft een tetraëdrische moleculaire geometrie, met de zwavelatomen in het midden van de tetraëder.
Oplosbaarheid van natriummetabisulfiet
Na2S2O5 is zeer oplosbaar in water, met een oplosbaarheid van 54 g/100 ml bij 25°C. Het is ook oplosbaar in glycerol en enigszins oplosbaar in ethanol. De oplosbaarheid van een stof is een belangrijke eigenschap die het vermogen ervan bepaalt om in een bepaald oplosmiddel op te lossen.
| Verschijning | Wit of geelachtig kristallijn poeder |
| Soortelijk gewicht | 1.48 |
| Kleur | Wit tot geelachtig |
| Geur | Akko |
| Molaire massa | 190,107 g/mol |
| Dikte | 1,48 g/ml |
| Fusie punt | 150°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 54 g/100 ml bij 25°C |
| Oplosbaarheid | Oplosbaar in glycerol en enigszins oplosbaar in ethanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | 7.2 |
| pH | 4,5 (5% oplossing) |
Veiligheid en gevaren van natriummetabisulfiet
Na2S2O5 kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het is een sterk reductiemiddel dat bij blootstelling irritatie van de huid, ogen en luchtwegen kan veroorzaken. Inslikken van de verbinding kan ernstige maag-darmklachten veroorzaken. Na2S2O5 moet worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen. Het mag niet worden gemengd met sterke zuren, sterke oxidatiemiddelen of reductiemiddelen. Bij het hanteren van de verbinding moeten beschermende uitrusting, zoals handschoenen, een veiligheidsbril en een gasmasker, worden gebruikt. Noodmaatregelen, zoals oogspoelstations en brandblussers, moeten bij een ongeval direct beschikbaar zijn.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag beschermende kleding en handschoenen. Niet inslikken. Gebruiken met voldoende ventilatie. |
| VN-identificatienummers | VN 2676 |
| HS-code | 2832.10.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat): 1.000 mg/kg; LC50 (inhalatie, rat): 11 mg/L (4 uur) |
Methoden voor de synthese van natriummetabisulfiet
Na2S2O5 kan op verschillende manieren worden gesynthetiseerd, waaronder het laten reageren van natriumbisulfiet met zwaveldioxide in aanwezigheid van een oxidatiemiddel zoals waterstofperoxide . Het proces verwarmt het adduct van natriumbisulfiet en zwaveldioxide om Na2S2O5 te vormen.
Een andere methode omvat de reactie van natriumhydroxide met zwaveldioxidegas, gevolgd door de toevoeging van zwavelzuur om natriumsulfaat en Na2S2O5 te vormen.
Een andere synthesemethode omvat het laten reageren van natriumcarbonaat met zwaveldioxide en het vervolgens verwarmen van het resulterende natriumsulfiet in aanwezigheid van lucht. Dit proces produceert natriumsulfaat en Na2S2O5.
In aanwezigheid van een oxidatiemiddel zoals waterstofperoxide of salpeterzuur kan Na2S2O5 worden bereid door zwavel te laten reageren met natriumsulfiet.
In de industrie is de meest gebruikelijke methode voor het synthetiseren van Na2S2O5 het laten reageren van natriumbisulfiet met zwaveldioxide in aanwezigheid van een katalysator zoals mangaandioxide. Door het natriumbisulfiet/zwaveldioxide-adduct te verwarmen ontstaat Na2S2O5.
Gebruik van natriummetabisulfiet
Na2S2O5 heeft verschillende toepassingen in verschillende industrieën vanwege de sterke reducerende eigenschappen en het vermogen om als conserveermiddel en antioxidant te werken. Enkele veel voorkomende toepassingen van Na2S2O5 zijn:
- Voedings- en drankenindustrie: veel gebruikt als conserveermiddel en antioxidant in voedingsmiddelen en dranken zoals wijn, bier, vruchtensappen en gedroogd fruit. Dit helpt bederf en oxidatie van deze producten te voorkomen, waardoor de houdbaarheid ervan wordt verlengd.
- Farmaceutische Industrie: Gebruikt als antioxidant in verschillende farmaceutische producten zoals crèmes, zalven en tabletten. Het helpt de afbraak van deze producten als gevolg van blootstelling aan lucht en licht te voorkomen.
- Waterbehandeling: Gebruikt om water in waterzuiveringsinstallaties te dechloreren. Het helpt bij het elimineren van overmatig chloor en chlooramines, die schadelijk kunnen zijn voor het waterleven.
- Fotografie: Gebruikt als fotografische ontwikkelaar en fixer in de fotografie-industrie. Het helpt de zilverionen te reduceren tot metallisch zilver, waardoor het fotografische beeld ontstaat.
- Textielindustrie: Gebruikt als reductiemiddel in de textielindustrie voor verf- en drukprocessen. Het helpt overtollige zuurstof uit de kleurstofoplossing te verwijderen, waardoor de kleurintensiteit en uniformiteit worden verbeterd.
Vragen:
Vraag: Waar kan ik lokaal natriummetabisulfiet kopen?
A: Na2S2O5 is meestal te vinden in chemicaliënwinkels of online winkels. Het is mogelijk ook verkrijgbaar in sommige speciaalzaken, omdat het vaak wordt gebruikt als conserveermiddel in de voedingsindustrie.
Vraag: Waar kan ik natriummetabisulfiet kopen?
A: Na2S2O5 kan worden gekocht bij chemische winkels of online speciaalzaken voor chemicaliën. Het is mogelijk ook verkrijgbaar bij sommige speciaalzaken.
Vraag: Is natriummetabisulfiet veilig?
A: Na2S2O5 kan gevaarlijk zijn als het niet op de juiste manier wordt behandeld. Het is belangrijk om geschikte beschermende uitrusting te dragen en veiligheidsmaatregelen te volgen bij het hanteren van deze verbinding. Het kan huid- en oogirritatie veroorzaken en kan bij vermenging met zuur ook giftig zwaveldioxide vrijgeven. Wanneer het echter in de juiste concentraties wordt gebruikt en met zorg wordt behandeld, wordt Na2S2O5 over het algemeen als veilig beschouwd voor het beoogde gebruik.
Vraag: Kun je natriumbisulfaat omzetten in natriummetabisulfiet?
A: Ja, natriumbisulfaat (NaHSO4) kan worden omgezet in Na2S2O5 door het tot hoge temperatuur te verwarmen in aanwezigheid van een oxidatiemiddel, zoals waterstofperoxide. De reactie resulteert in het vrijkomen van water en de vorming van Na2S2O5.
Vraag: Wat is het verschil tussen natriumbisulfiet en natriummetabisulfiet?
A: Het belangrijkste verschil tussen NaHSO3 en Na2S2O5 is hun chemische structuur. Natriumbisulfiet heeft één sulfietgroep (-SO3) en één waterstofion (H+), terwijl Na2S2O5 twee aan elkaar gebonden sulfietgroepen (-SO3) heeft. Na2S2O5 is ook stabieler en langer houdbaar dan natriumbisulfiet.
Vraag: Wat is het oxidatiegetal van S in Na2S2O5?
A: Het oxidatiegetal van zwavel (S) in Na2S2O5 is +5.
Vraag: Hoe vind ik een concentratie van IO3- uit KIO3 en Na2S2O5?
A: De concentratie IO3- kan worden bepaald door titratie met een bekende concentratie natriumthiosulfaat (Na2S2O3), waarbij zetmeel als indicator wordt gebruikt. De reactie tussen KIO3 en Na2S2O5 produceert jodium (I2), dat reageert met Na2S2O3 om NaI en Na2S4O6 te vormen. Door het volume Na2S2O3 te meten dat nodig is om met jodium te reageren, kan de concentratie IO3- worden berekend.
Vraag: Welke ionen bevat Na2S2O5?
A: Na2S2O5 bestaat uit twee natriumionen (Na+) en één disulfietion (-S2O5).
