Natriumhydrosulfiet (Na2S2O4) is een wit kristallijn poeder dat wordt gebruikt als reductiemiddel in verschillende industrieën, zoals de textiel- en papierindustrie. Het verwijdert kleur uit stoffen en papierpulp.
| IUPAC-naam | Natriumdithioniet |
| Moleculaire formule | Na2S2O4 |
| CAS-nummer | 7775-14-6 |
| Synoniemen | Natriumhyposulfiet, natriumdithionaat, natriumsulfoxylaat, natriumwaterstofsulfiet |
| InChi | InChI=1S/2Na.H2O4S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschappen van natriumhydrosulfiet
Natriumhydrosulfietformule
De chemische formule voor natriumhydrosulfiet is Na2S2O4. Dit betekent dat elk molecuul natriumhydrosulfiet twee natriumatomen, twee zwavelatomen en vier zuurstofatomen bevat. De formule geeft aan dat de verbinding bestaat uit positief geladen natriumionen en negatief geladen sulfietionen.
Natriumhydrosulfiet molaire massa
De molaire massa van Na2S2O4 is 174,11 g/mol. Deze waarde wordt berekend door de atoommassa’s van de elementen aanwezig in een Na2S2O4-molecuul op te tellen. Molaire massa is een belangrijke parameter in de stoichiometrie en wordt gebruikt om de hoeveelheid stof in een bepaald monster van de verbinding te berekenen.
Kookpunt van natriumhydrosulfiet
Na2S2O4 is een stabiele verbinding en heeft geen kookpunt. In plaats daarvan ontleedt het bij verhitting boven 150°C, waarbij zwaveldioxide en waterdamp vrijkomen. De ontledingsreactie is exotherm en voorzichtigheid is geboden bij het verwarmen van Na2S2O4.
Smeltpunt van natriumhydrosulfiet
Het smeltpunt van Na2S2O4 is 300°C. Bij deze temperatuur smelt de vaste verbinding en vormt een kleurloze vloeistof. Het smeltpunt is een belangrijke parameter bij het bepalen van de stabiliteit van de verbinding en de geschiktheid ervan voor verschillende toepassingen.
Dichtheid van natriumhydrosulfiet g/ml
De dichtheid van Na2S2O4 bedraagt 1,48 g/ml. Deze waarde geeft aan dat Na2S2O4 een relatief dichte verbinding is vergeleken met water. Dichtheid is een belangrijke parameter bij het bepalen van de oplosbaarheid van de verbinding en het vermogen ervan om met andere stoffen te mengen.
Natriumhydrosulfiet Molecuulgewicht
Het molecuulgewicht van Na2S2O4 is 174,11 g/mol. Deze waarde wordt berekend door de atoommassa’s van de elementen aanwezig in een Na2S2O4-molecuul op te tellen. Het molecuulgewicht is een belangrijke parameter bij het bepalen van de hoeveelheid stof in een bepaald monster van de verbinding.
Structuur van natriumhydrosulfiet
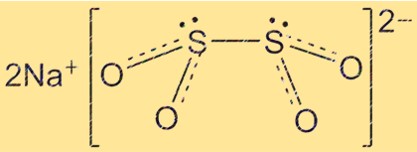
De structuur van Na2S2O4 is tetraëdrisch, waarbij de zwavelatomen zich op de hoeken van de tetraëder bevinden en de zuurstofatomen de randen vormen. Natriumionen bevinden zich in het midden van de tetraëder. De structuur van Na2S2O4 is belangrijk voor het begrijpen van de chemische en fysische eigenschappen ervan.
Oplosbaarheid van natriumhydrosulfiet
Na2S2O4 is zeer oplosbaar in water, met een oplosbaarheid van 58 g/100 ml bij 20°C. De oplosbaarheid wordt beïnvloed door temperatuur en pH, waarbij een hogere oplosbaarheid wordt waargenomen bij hogere temperaturen en lagere pH-waarden. De hoge oplosbaarheid van Na2S2O4 maakt het bruikbaar in diverse toepassingen, zoals de textiel- en papierindustrie, waar het als reductiemiddel wordt gebruikt.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1.48 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 174,11 g/mol |
| Dikte | 1,48 g/ml |
| Fusie punt | 300°C |
| Kookpunt | Ontleedt bij 150°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, glycerol, ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 6.6 |
| pH | 7-8 (1% oplossing) |
Veiligheid en gevaren van natriumhydrosulfiet
Na2S2O4 is over het algemeen veilig als het op de juiste manier wordt gehanteerd en gebruikt, maar kan bij verkeerd gebruik of ongepast gebruik enkele gevaren met zich meebrengen. Het is geclassificeerd als een gevaarlijke stof en kan irritatie aan de huid en ogen veroorzaken als het in contact komt met deze delen van het lichaam. Inademing van Na2S2O4-stof of -nevel kan ook de luchtwegen irriteren. Na2S2O4 is ook een reductiemiddel, wat betekent dat het kan reageren met andere chemicaliën en brandbare of explosieve gassen kan produceren. Passende veiligheidsmaatregelen, zoals het dragen van beschermende uitrusting en het hanteren van de stof in goed geventileerde ruimtes, moeten worden gevolgd om ongelukken en verwondingen te voorkomen.
| Gevarensymbolen | XI, C |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Adem geen stof of nevel in. Draag beschermende uitrusting. Hanteren in goed geventileerde ruimtes. |
| VN-identificatienummers | VN1384 |
| HS-code | 28311000 |
| Gevarenklasse | 4.2 |
| Verpakkingsgroep | III |
| Toxiciteit | LD50: 1.520 mg/kg (oraal, rat); LC50: 1840 ppm/4u (inhalatie, rat) |
Methoden voor de synthese van natriumhydrosulfiet
Er zijn verschillende methoden om Na2S2O4 te synthetiseren, maar de meest gebruikelijke is de reactie van natriumbisulfiet en natriumdithioniet.
Eén methode omvat het toevoegen van natriumbisulfiet aan een oplossing van natriumhydroxide en natriumdithioniet, terwijl een andere methode het verwarmen van een mengsel van natriumbisulfiet en natriumdithioniet omvat.
De vorming van Na2S2O4 produceert een wit kristallijn poeder dat met beide methoden kan worden verzameld en gezuiverd.
Een andere methode om Na2S2O4 te synthetiseren omvat de reactie tussen zwaveldioxide en natriumboorhydride . Bij de reactie ontstaan Na2S2O4, natriumboraat en waterstofgas. Deze methode is over het algemeen minder gebruikelijk dan de natriumbisulfiet- en natriumdithionietmethoden.
Gebruik van natriumhydrosulfiet
Na2S2O4 heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Textielindustrie: Gebruikt als reductiemiddel in de textielindustrie om overtollig verven en bleken uit stoffen te verwijderen.
- Papierindustrie: Gebruikt in de papierindustrie om houtpulp en papierproducten te bleken.
- Voedingsindustrie: Gebruikt als voedingsadditief om verkleuring te voorkomen en als conserveermiddel in ingeblikt fruit en groenten.
- Waterbehandeling: Wordt gebruikt om overtollig chloor te verwijderen bij de behandeling van drinkwater en afvalwater.
- Mijnbouw: Gebruikt in de mijnbouw om koper- en molybdeenertsen te scheiden.
- Polymeerindustrie: Gebruikt in de polymeerindustrie om de kleur van polymeren en kunststoffen te verminderen.
- Fotografie-industrie: Gebruikt in de fotografie-industrie als fotografisch fixeermiddel om niet-blootgestelde zilverhalogeniden uit fotografische afdrukken te verwijderen.
- Andere industriële toepassingen: gebruikt in verschillende andere industrieën, zoals leerverwerking, olieboringen en als reductiemiddel bij chemische synthesereacties.
Vragen:
Vraag: Welke reiniger bevat natriumhydrosulfiet?
A: Na2S2O4 wordt vaak gebruikt in huishoudelijke schoonmaakmiddelen om vlekken te verwijderen en als alternatief voor bleekmiddel.
Vraag: Wat is de functie van natriumhydrosulfiet in de reactie met indigo?
A: Na2S2O4 werkt als reductiemiddel bij de reactie met indigo, waardoor de onoplosbare indigoblauwe kleurstof wordt omgezet in een oplosbare, kleurloze verbinding.
Vraag: Waar kan ik natriumhydrosulfiet kopen?
A: Na2S2O4 kan worden gekocht bij chemische leveranciers, zoals Sigma-Aldrich, Fisher Scientific en VWR International.
Vraag: Hoe neutraliseer ik natriumhydrosulfiet?
A: Na2S2O4 kan worden geneutraliseerd met natriumhydroxide of een andere sterke base.
Vraag: Welke Indiase voedingsmiddelen gebruiken natriumhydrosulfiet?
A: Na2S2O4 wordt niet vaak gebruikt in Indiase voedingsmiddelen.
Vraag: Hoe wordt natriumhydrosulfiet witter?
A: Na2S2O4 werkt als een reductiemiddel en vernietigt de chemische bindingen die kleur aan het materiaal geven, waardoor de kleur wordt geëlimineerd en er verbleking optreedt.
Vraag: Wat is de functie van natriumhydrosulfiet in de reactie met indigo?
A: Na2S2O4 werkt als reductiemiddel bij de reactie met indigo, waardoor de onoplosbare indigoblauwe kleurstof wordt omgezet in een oplosbare, kleurloze verbinding.
Vraag: Wat veroorzaakt een geur bij het toevoegen van natriumhydrosulfiet?
A: Bij het toevoegen van Na2S2O4 kan er een zwavelgeur ontstaan als gevolg van het vrijkomen van zwaveldioxidegas.
Vraag: Is natriumhydrosulfietdihydraat een reductiemiddel?
A: Ja, Na2S2O4-dihydraat is een krachtig reductiemiddel dat veel wordt gebruikt in industriële processen.
