Natriumdichromaat is een chemische verbinding. Het is een oxidatiemiddel en een zeer giftige stof. Het wordt gebruikt in verschillende industriële processen, zoals het verzinken van metalen en de productie van pigmenten.
| IUPAC-naam | Natriumdichromaat |
| Moleculaire formule | Na2Cr2O7 |
| CAS-nummer | 10588-01-9 |
| Synoniemen | Natriumdichromaat, Dinatriumdichromaat, Natriumdichromaat |
| InChi | InChI=1S/2Cr.2Na.7O/q2*+6;2*+1;7*-2 |
Eigenschappen van natriumdichromaat
Natriumdichromaatformule
De formule voor natriumdichromaat is Na2Cr2O7. Het bestaat uit twee natriumatomen (Na), twee chroomatomen (Cr) en zeven zuurstofatomen (O). De formule vertegenwoordigt de verhouding van elk element in de verbinding.
Natriumdichromaat molaire massa
De molaire massa van natriumdichromaat wordt berekend door de atoommassa’s van alle samenstellende elementen op te tellen. Natrium (Na) heeft een atoommassa van 22,99 g/mol, chroom (Cr) heeft een massa van 51,99 g/mol en zuurstof (O) heeft een massa van 16,00 g/mol. Optelling van deze waarden levert een molaire massa op van 261,97 g/mol voor natriumdichromaat.
Kookpunt van natriumdichromaat
Natriumdichromaat heeft een kookpunt van ongeveer 400°C (752°F). Dit is de temperatuur waarbij de verbinding overgaat van een vloeibare fase naar een gasfase bij verhitting onder normale atmosferische druk.
Natriumdichromaat Smeltpunt
Het smeltpunt van natriumdichromaat is ongeveer 357°C (675°F). Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. Het is belangrijk op te merken dat het smeltpunt enigszins kan variëren, afhankelijk van de zuiverheid van het monster.
Dichtheid van natriumdichromaat g/ml
De dichtheid van natriumdichromaat is ongeveer 2,52 g/ml. Dichtheid is een maat voor de massa van een stof per volume-eenheid. In het geval van natriumdichromaat geeft deze waarde aan dat een bepaald volume van de verbinding relatief zwaar is.
Natriumdichromaat Molecuulgewicht
Het molecuulgewicht van natriumdichromaat is 261,97 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen die aanwezig zijn in een molecuul van de verbinding.
Structuur van natriumdichromaat
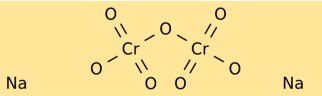
Natriumdichromaat heeft een kristalstructuur die heldere roodoranje kristallen vormt. Het bestaat uit natriumionen (Na+) en dichromaationen (Cr2O7^2-). Het dichromaation heeft een centraal chroomatoom gebonden aan twee zuurstofatomen aan de ene kant en drie zuurstofatomen aan de andere kant.
Oplosbaarheid van natriumdichromaat
Natriumdichromaat is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een geeloranje oplossing. De oplosbaarheid van natriumdichromaat in water wordt beïnvloed door factoren zoals temperatuur en pH, waarbij hogere temperaturen en lagere pH-niveaus de oplosbaarheid vergroten.
| Verschijning | Roodoranje kristallen |
| Soortelijk gewicht | 2.52 |
| Kleur | Helder roodoranje |
| Geur | Geurloos |
| Molaire massa | 261,97 g/mol |
| Dikte | 2,52 g/ml |
| Fusie punt | 357°C (675°F) |
| Kookpunt | 400°C (752°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, enigszins oplosbaar in ethanol/methanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van natriumdichromaat
Natriumdichromaat brengt aanzienlijke veiligheidsrisico’s met zich mee. Het is zeer giftig als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Dit kan bij contact ernstige brandwonden en oogletsel veroorzaken. De verbinding is ook geclassificeerd als een potentieel carcinogeen, dat kanker kan veroorzaken. Bovendien is het een oxidatiemiddel, wat betekent dat het heftig kan reageren met brandbare materialen, waardoor het risico op brand of explosie toeneemt. Bij het hanteren van natriumdichromaat moeten passende veiligheidsmaatregelen worden genomen, waaronder het gebruik van beschermende kleding, handschoenen en een bril. Het moet worden opgeslagen in een veilige, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Bij blootstelling of inslikken is onmiddellijke medische hulp van cruciaal belang.
| Gevarensymbolen | Bijtend, gevaar voor de gezondheid |
| Beveiligingsbeschrijving | Zeer giftig, bijtend, kankerverwekkend |
| VN-identificatienummers | UN3086 |
| HS-code | 28415000 |
| Gevarenklasse | 6.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van natriumdichromaat
Er zijn verschillende methoden voor het synthetiseren van natriumdichromaat. Een veelgebruikte methode is de reactie tussen natriumchromaat (Na2CrO4) en natriumdichromaat (Na2Cr2O7). Zwavelzuur (H2SO4) reageert met natriumchromaat en produceert natriumdichromaat en water. De chemische vergelijking voor deze reactie is:
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Een andere methode omvat de oxidatie van natriumchromaat met behulp van een sterk oxidatiemiddel, zoals kaliumpermanganaat (KMnO4) . Bij deze reactie reageert natriumchromaat met kaliumpermanganaat in aanwezigheid van zwavelzuur, waarbij natriumdichromaat, mangaandioxide (MnO2) en water worden geproduceerd.
2Na2CrO4 + 6KMnO4 + 7H2SO4 → 2Na2Cr2O7 + 6MnO2 + 7K2SO4 + 8H2O
Bij de reactie tussen natriumhydroxide (NaOH) en chroomtrioxide (CrO3) ontstaat natriumdichromaat. De reactie vindt plaats in een waterig medium en produceert natriumdichromaat en water.
2NaOH + CrO3 → Na2Cr2O7 + H2O
Bij het implementeren van deze synthetische methoden moeten individuen voorzichtig zijn vanwege de toxische en gevaarlijke aard van natriumdichromaat. Het gebruik van passende veiligheidsmaatregelen en beschermende uitrusting is absoluut noodzakelijk om het welzijn van degenen die bij het proces betrokken zijn te garanderen.
Gebruik van natriumdichromaat
Natriumdichromaat heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Metaalplating: Bij galvaniseerprocessen wordt natriumdichromaat gebruikt om een beschermende en decoratieve coating aan te brengen op verschillende metalen oppervlakken, zoals staal, aluminium en zink.
- Pigmentproductie: Natriumdichromaat speelt een cruciale rol bij de productie van pigmenten zoals chroomgeel en chroomgroen, die veel voorkomen in verven, inkten en kleurstoffen.
- Houtconserveringsmiddel: Natriumdichromaat, met zijn sterk oxiderende eigenschappen, beschermt hout tegen rot, insecten en schimmels, vooral bij buitentoepassingen.
- Leerlooien: De leerlooierij gebruikt natriumdichromaat als beitsmiddel tijdens het leerbehandelingsproces, waardoor de kleurvastheid en duurzaamheid van het leer worden verbeterd.
- Chemische synthese: Natriumdichromaat fungeert als reagens bij verschillende chemische reacties, waaronder de synthese van organische verbindingen, oxidatiereacties en de bereiding van andere chroomverbindingen.
- Laboratoriumtoepassingen: Natriumdichromaat vindt laboratoriumtoepassingen voor analytische tests, kalibratiestandaarden en chemisch onderzoek.
- Textielindustrie: Natriumdichromaat verbetert de kleurechtheid en bevordert een betere hechting van kleurstoffen aan de stof tijdens het verven en bedrukken van textiel.
- Fotografie: Natriumdichromaat is een cruciaal onderdeel van lichtgevoelige emulsies en fungeert als oxidatiemiddel bij sommige fotografische processen.
Het is belangrijk om voorzichtig om te gaan met natriumdichromaat, de veiligheidsinstructies en de juiste verwijderingsmethoden te volgen, vanwege de toxiciteit en de impact ervan op het milieu.
Vragen:
Vraag: Hoeveel zuurstofatomen zitten er in 3,00 g natriumdichromaat, Na2Cr2O7?
A: Er zijn 6,02 x 10^22 zuurstofatomen in 3,00 g natriumdichromaat.
Vraag: Hoeveel zuurstofatomen zitten er in 4,00 g natriumdichromaat, Na2Cr2O7?
A: Er zijn 8,03 x 10^22 zuurstofatomen in 4,00 g natriumdichromaat.
Vraag: Hoeveel zuurstofatomen zitten er in 5,00 g natriumdichromaat, Na2Cr2O7?
A: Er zitten 1,00 x 10^23 zuurstofatomen in 5,00 g natriumdichromaat.
Vraag: Hoeveel zuurstofatomen zitten er in 6,00 g natriumdichromaat, Na2Cr2O7?
A: Er zijn 1,20 x 10^23 zuurstofatomen in 6,00 g natriumdichromaat.
Vraag: Hoeveel zuurstofatomen zitten er in 7,00 g natriumdichromaat?
A: Er zijn 1,40 x 10^23 zuurstofatomen in 7,00 g natriumdichromaat.
Vraag: MSDS van natriumdichromaat?
A: Het veiligheidsinformatieblad (MSDS) voor natriumdichromaat biedt gedetailleerde informatie over de eigenschappen, voorzorgsmaatregelen en veiligheidsmaatregelen.
Vraag: Wat zou natriumdichromaat kunnen vervangen?
A: Alternatieven voor natriumdichromaat omvatten andere chroomverbindingen, zoals driewaardige chroomzouten of niet-chroomstoffen, afhankelijk van de specifieke toepassing.
Vraag: Waar wordt natriumdichromaat voor gebruikt?
A: Natriumdichromaat wordt gebruikt als oxidatiemiddel, houtverduurzamingsmiddel en pigment, maar ook in verschillende industriële processen zoals het verchromen van metalen en het looien van leer.
Vraag: Kan een gele chromaatoplossing worden gemaakt van natriumdichromaatdihydraat?
A: Ja, een geelchromaatoplossing kan worden bereid door natriumdichromaatdihydraat in water op te lossen.
Vraag: Wat is de formule voor natriumdichromaat?
A: De formule voor natriumdichromaat is Na2Cr2O7.
Vraag: Is natriumdichromaat anorganisch?
A: Ja, natriumdichromaat is een anorganische verbinding.
Vraag: Waar wordt natriumdichromaat op getest?
A: Natriumdichromaat kan worden gebruikt voor testdoeleinden, bijvoorbeeld om de aanwezigheid van bepaalde stoffen te beoordelen of om specifieke chemische reacties te monitoren.
