Natriumboraat is een verbinding die in verschillende industrieën wordt gebruikt. Het heeft meerdere toepassingen, als reinigingsmiddel, vloeimiddel in de metallurgie en als onderdeel van cosmetica en wasmiddelen.
| IUPAC-naam | Natriumboraat |
| Moleculaire formule | Na2B4O7 |
| CAS-nummer | 1330-96-4 |
| Synoniemen | Borax, natriumtetraboraat, dinatriumtetraboraat, natriumbiboraat |
| InChi | InChI=1S/B4O7.2Na/c5-1-7-3-9-2-8-4-10-3;;/q-2;2*+1 |
Eigenschappen van natriumboraat
Natriumboraatformule
De chemische formule voor natriumboraat is Na2B4H20O17. Het bestaat uit twee natriumatomen (Na), vier booratomen (B) en zeven zuurstofatomen (O). De formule vertegenwoordigt de verhouding van elk element in de verbinding.
Natriumboraat molaire massa
De molaire massa van borax wordt berekend door de atoommassa’s van alle atomen in de verbinding op te tellen. De molaire massa van borax is ongeveer 381,37 gram per mol (g/mol). Het is nuttig voor het bepalen van de hoeveelheid stof die in een bepaald monster aanwezig is.
Kookpunt van natriumboraat
Borax heeft een relatief hoog kookpunt. Bij standaard atmosferische druk kookt het bij ongeveer 1,575 graden Celsius (C). Dit hoge kookpunt maakt het geschikt voor diverse industriële toepassingen waarbij processen bij hoge temperaturen betrokken zijn.
Natriumboraat Smeltpunt
Borax heeft een smeltpunt van ongeveer 741 graden Celsius (C). Bij deze temperatuur ondergaat het een faseovergang van vaste naar vloeibare toestand. Door het relatief lage smeltpunt kan borax gemakkelijk smelten en in verschillende productieprocessen worden gebruikt.
Dichtheid van natriumboraat g/ml
De dichtheid van borax is ongeveer 1,73 gram per milliliter (g/ml). Dichtheid is een maatstaf voor de hoeveelheid massa die zich in een bepaald volume bevindt. De relatief hoge dichtheid van borax maakt het een bruikbare verbinding in toepassingen waarbij het gewicht of de concentratie belangrijk zijn.
Natriumboraat Molecuulgewicht
Het molecuulgewicht van borax is ongeveer 381,37 gram per mol (g/mol). Het vertegenwoordigt de som van de atoomgewichten van alle atomen in een boraxmolecuul. Het molecuulgewicht is essentieel voor verschillende berekeningen, zoals het bepalen van het aantal mol of de massa van een stof.
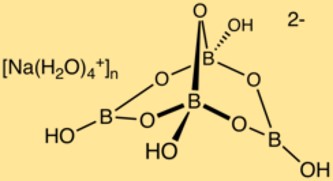
Structuur van natriumboraat
Borax heeft een complexe kristalstructuur bestaande uit boor-zuurstofveelvlakken en natriumionen. De booratomen vormen een netwerk met de zuurstofatomen, waardoor een driedimensionale structuur ontstaat. In deze structuur bevinden zich natriumionen, die de stabiliteit van de verbinding garanderen.
Oplosbaarheid van natriumboraat
Borax is matig oplosbaar in water. Het lost gemakkelijk op in heet water en de oplosbaarheid ervan neemt toe met de temperatuur. De oplosbaarheid ervan in organische oplosmiddelen is echter beperkt. De oplosbaarheid van borax maakt het bruikbaar voor een verscheidenheid aan toepassingen, onder meer als reinigingsmiddel en bij het formuleren van oplossingen en mengsels.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1,73 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 381,37 g/mol |
| Dikte | 1,73 g/ml |
| Fusie punt | 741°C |
| Kookpunt | 1575°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, beperkte oplosbaarheid in organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Rond 9.00-10.00 uur |
Veiligheid en gevaren van natriumboraat
Borax moet met voorzichtigheid worden gehanteerd vanwege de potentiële veiligheidsrisico’s. Het kan irritatie van de huid, ogen en luchtwegen veroorzaken bij direct contact of inademing. Inslikken van grote hoeveelheden kan maag-darmklachten veroorzaken. Bij het werken met borax moeten beschermende maatregelen, zoals handschoenen en een veiligheidsbril, worden gebruikt om blootstelling te voorkomen. Het is belangrijk om het op te slaan in een veilige, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Als inslikken of accidentele blootstelling plaatsvindt, moet onmiddellijk medische hulp worden ingeroepen. De toepasselijke veiligheidsinformatiebladen en gebruiksinstructies moeten worden geraadpleegd voor gedetailleerde informatie over de gevaren van borax en veiligheidsmaatregelen.
| Gevarensymbolen | Giftig |
| Beveiligingsbeschrijving | Schadelijk bij inslikking. Veroorzaakt huid- en oogirritatie. |
| VN-identificatienummers | VN 1458 |
| HS-code | 2840.19.20 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Matige toxiciteit bij inslikken of huid-/oogcontact. |
Methoden voor de synthese van natriumboraat
Er zijn verschillende methoden voor het synthetiseren van borax. Een veel voorkomende methode is de reactie tussen borax (natriumtetraboraatdecahydraat) en natriumcarbonaat . Los bij dit proces borax op in water en voeg vervolgens natriumcarbonaat toe aan de oplossing. De reactie vindt plaats, waarbij borax wordt gevormd en een vaste stof neerslaat. Scheid en droog de vaste stof om borax te verkrijgen.
Een andere methode is om boorzuur in water op te lossen en geleidelijk natriumhydroxide aan de oplossing toe te voegen. De reactie vindt plaats en vormt borax. Damp de oplossing in om overtollig water te verwijderen en boraxkristallen te verkrijgen.
Meng bovendien booroxide met natriumhydroxide in een geschikt oplosmiddel en verwarm het mengsel. De reactie vindt plaats en vormt borax. Filtreer het mengsel om onzuiverheden af te scheiden en laat het filtraat afkoelen en kristalliseren, waardoor borax ontstaat.
Deze synthetische methoden bieden routes om op een gecontroleerde manier borax te verkrijgen. Het is echter belangrijk om tijdens het syntheseproces de juiste veiligheidsmaatregelen te volgen en op verantwoorde wijze met chemicaliën om te gaan.
Gebruik van natriumboraat
Borax, ook wel borax genoemd, heeft vanwege zijn veelzijdige eigenschappen een breed scala aan toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Flux in de metallurgie: Het dient als een flux bij las- en soldeertoepassingen, helpt het smeltpunt van metalen te verlagen en de stroom van gesmolten metaal te vergemakkelijken.
- Vlamvertrager: Het wordt toegepast als vlamvertrager in verschillende materialen, waaronder cellulose-isolatie, textiel en houtproducten.
- Glas en keramiek: Borax is een essentieel onderdeel bij de vervaardiging van glas en keramiek. Het helpt het smeltpunt te verlagen, de duurzaamheid te verbeteren en de optische eigenschappen van deze materialen te verbeteren.
- pH-buffer: Het functioneert als pH-buffer in laboratoria en wetenschappelijke experimenten.
- Reinigingsmiddel: Huishoudelijke producten zoals wasmiddelen, afwasmiddel en allesreinigers gebruiken borax effectief als reinigingsmiddel.
- Cosmetica: Cosmetica en producten voor persoonlijke verzorging gebruiken borax als buffermiddel, pH-regelaar en emulgator.
- Conserveermiddel: Houtproducten bevatten borax als conserveermiddel om schimmel- en insectenplagen te voorkomen.
- Landbouw: Borax fungeert als meststof met micronutriënten om boortekorten in gewassen te corrigeren, waardoor een gezonde plantengroei wordt bevorderd.
- Medische toepassingen: Medicinale formuleringen bevatten borax vanwege zijn antiseptische en adstringerende eigenschappen.
- Waterbehandeling: Waterbehandelingsprocessen gebruiken borax om de algengroei te remmen en de pH-waarde onder controle te houden.
Deze uiteenlopende toepassingen benadrukken het belang van borax in verschillende industrieën, waardoor het een waardevolle en veelzijdige verbinding is.
Vragen:
Vraag: Waar wordt natriumboraat voor gebruikt?
A: Borax wordt gebruikt als reinigingsmiddel, als vloeimiddel in de metallurgie, als onderdeel van cosmetica, als vlamvertrager, bij de productie van glas/keramiek, als houtconserveermiddel, enz.
Vraag: Waar kan ik natriumboraat kopen?
A: Borax kan worden gekocht bij verschillende chemische leveranciers, bouwmarkten, online markten en sommige supermarkten.
Vraag: Wat zal het kation zijn als het natriumboraat oplost?
A: Het kation dat vrijkomt wanneer borax oplost, is natrium (Na+).
Vraag: Is natriumboraat hetzelfde als boorzuur?
A: Nee, borax en boorzuur zijn verschillende verbindingen, hoewel ze allebei boor bevatten.
Vraag: Is natriumboraat hetzelfde als borax?
A: Ja, borax wordt gewoonlijk borax genoemd.
Vraag: Is natriumboraat gebaseerd?
A: Borax fungeert als een zwakke base in waterige oplossingen.
Vraag: Is natriumboraat veilig om te drinken?
A: Borax mag niet worden ingenomen, omdat het giftig kan zijn. Het is niet bedoeld voor consumptie.
Vraag: Neutraliseert natriumboraat zwavelzuur?
A: Nee, borax neutraliseert zwavelzuur niet. Het kan reageren, maar zal het niet volledig neutraliseren.
Vraag: Wat is de functie van natriumboraat in pH 10-elutiebuffer?
A: Borax in elutiebuffer met pH 10 vergemakkelijkt de elutie van negatief geladen biomoleculen uit chromatografiekolommen.
Vraag: Wat is borax?
A: Borax, ook bekend als natriumboraat, is een natuurlijk voorkomende minerale verbinding die bestaat uit natrium-, boor-, zuurstof- en watermoleculen.
Vraag: Wat gebeurt er als borax sterk wordt verwarmd?
A: Wanneer borax sterk wordt verwarmd, ondergaat het uitdroging en verliest het zijn watermoleculen, wat resulteert in de vorming van watervrije borax.
Vraag: Is borax hetzelfde als boorzuur?
A: Nee, borax en boorzuur zijn verschillende verbindingen. Borax is natriumboraat, terwijl boorzuur een zure vorm van boor is.
Vraag: Wat is boraxpoeder?
A: Boraxpoeder verwijst naar de poedervorm van borax, die voor verschillende doeleinden wordt gebruikt, zoals schoonmaken, wassen en handwerken.
