Natriumbicarbonaat (NaHCO3), ook wel zuiveringszout genoemd, is een wit kristallijn poeder met een licht alkalische smaak. Het wordt vaak gebruikt als afscheidingsmiddel bij het bakken, als reinigingsmiddel en bij de behandeling van zure oprispingen en brandend maagzuur.
| IUPAC-naam | Natriumwaterstofcarbonaat |
| Moleculaire formule | NaHCO3 |
| CAS-nummer | 144-55-8 |
| Synoniemen | Zuiveringszout, natriumwaterstofcarbonaat, natriumwaterstofcarbonaat |
| InChi | InChI=1S/CHNaO3/c2-1(3)4/h(H,2,3)(H2,1,2,3)/p-1 |
Eigenschappen van natriumbicarbonaat
Molaire massa van natriumbicarbonaat
De molaire massa van NaHCO3 is 84,007 g/mol. Het is de som van de atoommassa’s van de samenstellende elementen: natrium, waterstof, koolstof en zuurstof.
Kookpunt van natriumbicarbonaat
Natriumwaterstofcarbonaat heeft geen vast kookpunt omdat het ontleedt voordat het wordt gekookt. De ontledingstemperatuur van natriumbicarbonaat is 851°C, waarna het uiteenvalt in natriumcarbonaat, kooldioxide en water.
Smeltpunt van natriumbicarbonaat
Natriumwaterstofcarbonaat heeft een smeltpunt van 50°C, waarna het verandert van een vast naar een wit kristallijn poeder.
Dichtheid van natriumbicarbonaat g/ml
De dichtheid van natriumwaterstofcarbonaat is ongeveer 2,165 g/ml. Deze waarde kan enigszins variëren, afhankelijk van de korrelgrootte en de mate van verdichting van het materiaal.
Molecuulgewicht van natriumbicarbonaat
Het molecuulgewicht van natriumbicarbonaat is 84,007 g/mol, berekend op basis van de molecuulformule NaHCO3.
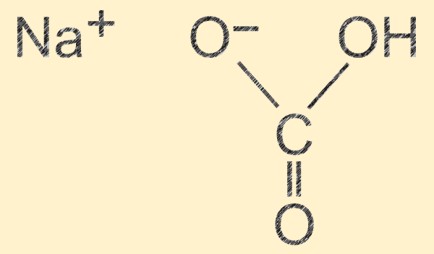
Structuur van natriumbicarbonaat
Natriumwaterstofcarbonaat heeft een moleculaire structuur die bestaat uit één natriumion (Na+), één waterstofion (H+), één carbonaation (CO32-) en drie zuurstofionen (O2-). De ionen zijn gerangschikt in een zich herhalende eenheid die een kristalstructuur vormt, met een waterstofbrug tussen de moleculen. De ionische aard van de verbinding geeft het zijn fundamentele eigenschappen en de waterstofbrug draagt bij aan de fysieke stabiliteit ervan.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2.165 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 84,007 g/mol |
| Dikte | 2.165 g/ml |
| Fusie punt | 50°C |
| Kookpunt | Ontleedt bij 851°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 8.1 |
| pH | 8,1 (10 g/l, 25°C) |
Veiligheid en gevaren van natriumbicarbonaat
Natriumbicarbonaat is een veilige en veelgebruikte verbinding met een laag toxiciteitsniveau. Het wordt over het algemeen als niet-gevaarlijk, niet-ontvlambaar en niet-explosief beschouwd. Inname van grote hoeveelheden kan spijsverteringsproblemen veroorzaken en het risico op het ontwikkelen van nierstenen vergroten. Contact met de huid kan lichte irritatie veroorzaken en het inademen van stof kan irritatie van de luchtwegen veroorzaken. Het is belangrijk om voorzichtig om te gaan met NaHCO3 om inademing van stof en contact met de huid te voorkomen.
| Gevarensymbolen | Niet toepasbaar |
| Beveiligingsbeschrijving | S24/25 |
| VN-identificatienummers | UN3077, MILIEUGEVAARLIJKE VASTE STOF, NEG (natriumbicarbonaat) |
| HS-code | 2836.90.90 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit bij inslikken, inademen of bij contact met de huid |
Methoden voor de synthese van natriumbicarbonaat
Natriumbicarbonaat (NaHCO3) kan op verschillende manieren worden gesynthetiseerd, waaronder het Solvay-proces, de meest gebruikte methode voor grootschalige productie. Het Solvay-proces omvat de reactie van natriumchloride, ammoniak en kooldioxide om natriumwaterstofcarbonaat en calciumchloride te produceren. Natriumwaterstofcarbonaat kan ook worden gesynthetiseerd door de reactie van NaHCO3 en kooldioxide, of door de reactie van natriumhydroxide en kooldioxide. Deze methoden produceren een zeer zuivere vorm van NaHCO3, die verder kan worden gezuiverd door herkristallisatie.
Gebruik van natriumbicarbonaat
Natriumwaterstofcarbonaat, beter bekend als zuiveringszout, heeft vanwege zijn unieke eigenschappen een breed scala aan toepassingen. Bij het koken wordt het vaak gebruikt als afscheidingsmiddel voor gebak, zoals cakes en brood. In de persoonlijke verzorging wordt het gebruikt als mild schuurmiddel in tandpasta en als deodorant. Het wordt ook in de voedingsindustrie gebruikt als pH-regelaar en neutralisatiemiddel. Natriumwaterstofcarbonaat heeft ook medicinale toepassingen, zoals de behandeling van brandend maagzuur, indigestie en zuurgraad. Bovendien wordt het gebruikt bij de productie van schoonmaakproducten en brandblussers vanwege zijn brandbluseigenschappen. Natriumwaterstofcarbonaat heeft ook milieuvriendelijke toepassingen, omdat het kan worden gebruikt om zuur afvalwater te neutraliseren.
