Natriumacetaat (C2H3NaO2) is een verbinding bestaande uit Na+- en C2H3O2–ionen. Het wordt vaak gebruikt als voedingsadditief en in medische toepassingen, zoals in dialyseoplossingen, en als koolstofbron voor bepaalde bacteriën.
| IUPAC-naam | Natriumacetaat |
| Moleculaire formule | C2H3NaO2 |
| CAS-nummer | 127-09-3 |
| Synoniemen | Natriumzout van azijnzuur, natriumethanoaat, Natriumacetaat |
| InChi | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Eigenschappen van natriumacetaat
Natriumacetaatformule
De chemische formule voor natriumacetaat is NaC2H3O2. Dit geeft aan dat de verbinding bestaat uit één Na+-ion en één C2H3O2–ion. Het C2H3O2-ion bestaat uit één koolstofatoom, twee zuurstofatomen en drie waterstofatomen. De formule is nuttig voor het bepalen van de stoichiometrie van chemische reacties en voor het voorspellen van het gedrag van de verbinding onder verschillende omstandigheden.
Natriumacetaat molaire massa
NaC2H3O2 heeft een molaire massa van 82,03 g/mol. Dit betekent dat één mol NaC2H3O2 82,03 gram weegt. De molaire massa wordt berekend door de atoommassa’s van elk element in de verbinding op te tellen. Natrium heeft een massa van 22,99 g/mol, koolstof heeft een massa van 12,01 g/mol, waterstof heeft een massa van 1,01 g/mol en zuurstof heeft een massa van 16,00 g/mol. De molaire massa van NaC2H3O2 is nuttig bij het bepalen van de hoeveelheid verbinding die in een bepaald monster aanwezig is.
Kookpunt van natriumacetaat
NaC2H3O2 heeft een kookpunt van 881°C (1.618°F). Het kookpunt is de temperatuur waarbij een stof overgaat van een vloeistof naar een gas. Het hoge kookpunt van NaC2H3O2 is te wijten aan de sterke ionische bindingen tussen de natrium- en acetaationen. Bij hoge temperaturen worden deze verbindingen verbroken en verdampt de verbinding.
Natriumacetaat Smeltpunt
NaC2H3O2 heeft een smeltpunt van 324°C (615°F). Het smeltpunt is de temperatuur waarbij een stof overgaat van een vaste naar een vloeibare toestand. Het hoge smeltpunt van NaC2H3O2 is ook te wijten aan de sterke ionische bindingen tussen de natrium- en acetaationen. Bij hoge temperaturen worden deze bindingen verzwakt en smelt de verbinding.
Dichtheid van natriumacetaat g/ml
NaC2H3O2 heeft een dichtheid van 1,45 g/ml. Dichtheid is de hoeveelheid massa per volume-eenheid van een stof. De hoge dichtheid van NaC2H3O2 is te danken aan de compacte opstelling van de moleculen. De dichtheid van NaC2H3O2 kan variëren afhankelijk van de concentratie in een oplossing.
Natriumacetaat Molecuulgewicht
Het molecuulgewicht van NaC2H3O2 is 82,03 g/mol. Het is de massa van één mol van de verbinding. Het molecuulgewicht is nuttig voor het bepalen van de hoeveelheid van een verbinding in een bepaald monster, maar ook voor het berekenen van de stoichiometrie van chemische reacties.
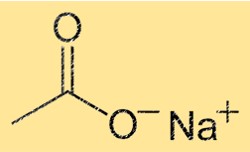
Structuur van natriumacetaat
NaC2H3O2 heeft een kristalstructuur met een herhalende eenheid Na(CH3COO). Dit betekent dat elke eenheidscel van het kristal één natriumion en één acetaation bevat. Het Na+-ion is omgeven door zes zuurstofatomen, terwijl het C2H3O2-ion bestaat uit één koolstofatoom, twee zuurstofatomen en drie waterstofatomen. De sterke ionische bindingen tussen de ionen geven het kristal zijn stabiliteit en zijn hoge smelt- en kookpunten.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,45 bij 20°C |
| Kleur | Kleurloos of wit |
| Geur | Geurloos |
| Molaire massa | 82,03 g/mol |
| Dikte | 1,45 g/cm³ bij 20°C |
| Fusie punt | 324°C (615°F) |
| Kookpunt | 881°C (1618°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 820 g/l (20°C) |
| Oplosbaarheid | Oplosbaar in water, ethanol, aceton |
| Dampdruk | 1 mm Hg bij 239,2°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 4,76 (bij 25°C) |
| pH | 7 (1% oplossing) |
Veiligheid en gevaren van natriumacetaat
NaC2H3O2 wordt over het algemeen als veilig beschouwd om te hanteren en te gebruiken als de juiste voorzorgsmaatregelen worden genomen. Het kan echter huid- en oogirritatie veroorzaken, en inname of inademing van grote hoeveelheden kan gastro-intestinale irritatie, ademhalingsproblemen en depressie van het centrale zenuwstelsel veroorzaken. NaC2H3O2 kan ook reageren met sterke oxidatiemiddelen, zuren en logen, waarbij hitte en gevaarlijke gassen ontstaan. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen bij het hanteren van NaC2H3O2, inclusief handschoenen en oogbescherming. NaC2H3O2 moet worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. In geval van accidentele blootstelling of inslikken, dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Niet inslikken of inhaleren. Gebruik in goed geventileerde ruimtes. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2915.21.00 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor de synthese van natriumacetaat
Er zijn verschillende methoden om NaC2H3O2 te synthetiseren, maar de meest voorkomende is de neutralisatiereactie van azijnzuur en natriumhydroxide . De reactievergelijking is als volgt:
CH3COOH + NaOH → CH3COONa + H2O
Om de reactie uit te voeren, wordt eerst een azijnzuuroplossing bereid door ijsazijn in water op te lossen. Voeg onder roeren langzaam natriumhydroxide toe aan de azijnzuuroplossing totdat de pH van de oplossing ongeveer 7 bereikt.
Op dit punt zal de oplossing NaC2H3O2 en water bevatten. Om vast NaC2H3O2 te verkrijgen, kan de oplossing op laag vuur worden verdampt totdat deze droogt. Als alternatief kan men de oplossing laten afkoelen tot kamertemperatuur en zullen de NaC2H3O2-kristallen vanzelf neerslaan.
Een andere methode om NaC2H3O2 te synthetiseren omvat de reactie tussen azijnzuuranhydride en natriumcarbonaat . De reactievergelijking is als volgt:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Bij deze reactie ontstaan NaC2H3O2, kooldioxide, koolmonoxide en water.
Door het reactiemengsel tot droog in te dampen en vervolgens te kristalliseren in water kan NaC2H3O2 in vaste vorm ontstaan. De hoge kosten van azijnzuuranhydride zorgen ervoor dat deze methode weinig wordt gebruikt.
Gebruik van natriumacetaat
NaC2H3O2 is een veelzijdige chemische stof met veel industriële en wetenschappelijke toepassingen. Hier zijn enkele van de meest voorkomende toepassingen:
- Buffermiddel: Vaak gebruikt als buffermiddel in chemische en biologische toepassingen. Het helpt een stabiele pH te behouden en zuurgraadschommelingen te voorkomen.
- Verwarmingspakketten: gebruikt bij de productie van verwarmingspakketten of verwarmingskussens. Deze zakjes zijn klein en kunnen verwarmen om warmte aan een specifiek deel van het lichaam te geven.
- Voedseladditief: gebruikt als voedseladditief, voornamelijk als smaakversterker, pH-regulator en conserveermiddel. Fabrikanten van bewerkte voedingsmiddelen verwerken het meestal in snacks, sauzen en vleesproducten.
- Textielindustrie: Gebruikt in de textielindustrie als verf- en drukhulpmiddel. Het helpt de kleurstofabsorptie en kleurvastheid van stoffen te verbeteren.
- Chemische synthese: Gebruikt als reagens bij verschillende chemische reacties. Het zet alcoholen om in de overeenkomstige alkylhalogeniden en produceert azijnzuuranhydride uit azijnzuur.
- Medische toepassingen: Gebruikt in medische toepassingen zoals hemodialyse en als onderdeel van elektrolytoplossingen.
- Fotografie: Gebruikt in de fotografie als fixeeroplossing om onbelichte zilverhalogeniden van fotoafdrukken en negatieven te verwijderen.
Vragen:
Vraag: Wat is het doel van natriumacetaat bij de amidesynthese?
A: NaC2H3O2 wordt bij de amidesynthese gebruikt als base om de aminegroep van het uitgangsmateriaal te deprotoneren. Dit vergemakkelijkt de reactie met het carbonzuur om de amidebinding te vormen.
Vraag: Wat is het doel van natriumacetaatoplossing bij de amidesynthese?
A: NaC2H3O2-oplossing wordt gebruikt als basische katalysator bij de synthese van amide. Het helpt de aminegroep van het uitgangsmateriaal te deprotoneren, waardoor deze reactiever wordt ten opzichte van het carbonzuur.
Vraag: Is natriumacetaat gebaseerd?
A: Ja, NaC2H3O2 is een base. Het is de geconjugeerde base van azijnzuur en heeft een pH van ongeveer 9 wanneer opgelost in water.
Vraag: Wat is natriumacetaat?
A: NaC2H3O2 is een natriumzout van azijnzuur, met de chemische formule NaCH3COO. Het is een wit, geurloos en kristallijn poeder, oplosbaar in water.
Vraag: Wat is het doel van een natriumacetaatoplossing bij de synthese van acetofenetidineamide?
A: Bij de amidesynthese van acetofenetidine wordt een NaC2H3O2-oplossing gebruikt als basische katalysator om de reactie tussen p-fenetidine en azijnzuuranhydride te vergemakkelijken. Het helpt de aminegroep van p-fenetidine te deprotoneren en deze te activeren voor een nucleofiele aanval door azijnzuuranhydride. Dit resulteert in de vorming van acetofenetidine.
