Natriumchloride (NaCl) is een verbinding bestaande uit natrium- en chloorionen. Het wordt gewoonlijk keukenzout genoemd en wordt gebruikt om voedsel op smaak te brengen en voedselproducten te conserveren.
| IUPAC-naam | Natriumchloride |
| Moleculaire formule | NaCl |
| CAS-nummer | 7647-14-5 |
| Synoniemen | Haliet, steenzout, zoutoplossing, zeezout |
| InChi | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Natriumchloride-formule
De chemische formule voor natriumchloride is NaCl, wat de combinatie vertegenwoordigt van een natriumion (Na+) en een chloride-ion (Cl-). De formule geeft het relatieve aantal atomen of ionen in de verbinding aan, waardoor de samenstelling ervan gemakkelijk kan worden geïdentificeerd en weergegeven.
Molaire massa van NaCl
De molaire massa van natriumchloride, ook wel tafelzout genoemd, is 58,44 g/mol. Dit betekent dat één mol natriumchloride 58,44 gram van de verbinding bevat. De molaire massa wordt berekend door de atoommassa’s van natrium (Na) en chloor (Cl) in de verbinding op te tellen, die respectievelijk 22,99 g/mol en 35,45 g/mol zijn.
Kookpunt van natriumchloride
Natriumchloride heeft een hoog kookpunt van 1413 ° C (2575 ° F) vanwege zijn ionische binding. Bij verhitting verbreekt de energie-invoer de ionische bindingen tussen de natrium- en chloride-ionen, waardoor de verbinding van fase verandert van een vaste naar een vloeibare toestand. Het kookpunt van natriumchloride is hoger dan dat van veel andere verbindingen vanwege de sterke elektrostatische aantrekkingskracht tussen de ionen.
Smeltpunt van natriumchloride
Het smeltpunt van natriumchloride is 801°C (1474°F). Net als het kookpunt is het hoge smeltpunt te wijten aan de sterke ionische bindingen tussen natrium- en chloride-ionen. Bij verhitting overwint de energie-input de elektrostatische krachten die de ionen bij elkaar houden, waardoor de verbinding overgaat van een vaste naar een vloeibare toestand.
Dichtheid van natriumchloride g/ml
De dichtheid van natriumchloride is 2,165 g/ml bij kamertemperatuur (25°C of 77°F). Dichtheid is een maat voor de massa per volume-eenheid van een stof. De hoge dichtheid van natriumchloride is te danken aan de compacte rangschikking van de atomen en de sterke ionische binding tussen de natrium- en chloride-ionen.
Molecuulgewicht van natriumchloride
Het molecuulgewicht van natriumchloride is 58,44 g/mol, zoals eerder vermeld. Het molecuulgewicht wordt berekend door de atoomgewichten van alle atomen in een molecuul op te tellen. Hoewel natriumchloride niet als molecuul in de traditionele zin bestaat, wordt het molecuulgewicht ervan berekend op basis van de formule-eenheid NaCl.
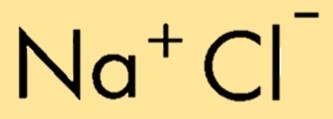
Structuur van natriumchloride
Natriumchloride heeft een kristalstructuur die bestaat uit een regelmatige opstelling van natrium- en chloride-ionen in een verhouding van 1:1. De structuur is een kubisch rooster met het gezicht in het midden, waarbij elk natriumion omgeven is door zes chloride-ionen en elk chloride-ion omgeven door zes natriumionen. De ionische binding in natriumchloride resulteert in een netwerkstructuur die zeer stabiel en moeilijk te doorbreken is.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2.165 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 58,44 g/mol |
| Dikte | 2.165 g/ml |
| Fusie punt | 801°C (1474°F) |
| Kookpunt | 1.413°C (2.575°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 359 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in water en glycerol; onoplosbaar in ethanol en aceton |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7 |
| pH | 7 (neutraal) |
Veiligheid en gevaren van natriumchloride
Natriumchloride (NaCl) wordt over het algemeen als veilig beschouwd voor menselijke consumptie en gebruik. Blootstelling aan hoge concentraties NaCl kan echter irritatie aan de ogen, huid en luchtwegen veroorzaken. Het innemen van grote hoeveelheden NaCl kan leiden tot uitdroging, verstoorde elektrolytenbalans en zelfs de dood. Natriumchloride kan ook brand- en explosiegevaar opleveren bij contact met brandbare materialen. Een juiste behandeling en opslag zijn noodzakelijk om ongelukken te voorkomen. Het is belangrijk om de juiste richtlijnen en veiligheidsmaatregelen te volgen bij het hanteren en gebruiken van NaCl om het risico op schade te minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Schadelijk bij inslikken of inademen. Veroorzaakt huid- en oogirritatie. |
| VN-identificatienummers | VN 7646 |
| HS-code | 2501.00.90 |
| Gevarenklasse | Niet giftig |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat) – 3.000 mg/kg |
Methoden voor de synthese van natriumchloride
Verschillende bronnen kunnen natriumchloride leveren, waaronder zoutmijnen en zeewater, maar het is ook mogelijk om het in het laboratorium te synthetiseren door middel van chemische reacties.
Een gebruikelijke methode voor het synthetiseren van natriumchloride omvat het laten reageren van zoutzuur (HCl) en natriumhydroxide (NaOH) . Deze reactie produceert natriumchloride en water als bijproducten. De vergelijking voor deze reactie is:
HCl + NaOH → NaCl + H2O
Een andere methode is het laten reageren van natriumcarbonaat (Na2CO3) met zoutzuur (HCl) om natriumchloride, kooldioxide en water te produceren. De vergelijking voor deze reactie is:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
De reactie tussen natrium- en chloorgas is zo’n methode om natriumchloride te synthetiseren. Deze reactie vereist hoge temperaturen en zorgvuldige controle om de vorming van ongewenste bijproducten te voorkomen. De vergelijking voor deze reactie is:
2Na + Cl2 → 2NaCl
Chemici kunnen ervoor kiezen om natriumchloridesynthesemethoden te wijzigen of te variëren op basis van factoren zoals kosten, beschikbaarheid van reagentia en de gewenste zuiverheid en opbrengst van het eindproduct. Deze methoden garanderen de productie van natriumchloride, zelfs als natuurlijke bronnen zeldzaam zijn.
Gebruik van natriumchloride
Natriumchloride, ook wel keukenzout genoemd, heeft vele toepassingen in verschillende industrieën en toepassingen. Enkele veel voorkomende toepassingen van natriumchloride zijn:
- Voedingsindustrie: Gebruikt als smaakmaker en smaakversterker in verschillende voedingsproducten, waaronder snacks, vleeswaren en gebak.
- Medische industrie: Gebruikt in intraveneuze oplossingen en andere medische behandelingen om de lichaamsvloeistoffen en elektrolyten aan te vullen.
- Chemische industrie: gebruikt bij de productie van verschillende chemicaliën, waaronder chloor, natriumhydroxide en natriumcarbonaat.
- Waterbehandeling: Gebruikt bij waterbehandeling om onzuiverheden te verwijderen en geschikt te maken om te drinken.
- Landbouw: Gebruikt als meststof voor gewassen, vooral in gebieden waar de bodem een tekort heeft aan essentiële voedingsstoffen.
- Ontdooien: Wordt in de winter gebruikt als ontdooimiddel op wegen en trottoirs om ongelukken door gladde oppervlakken te voorkomen.
- Textielindustrie: Gebruikt bij de productie van synthetische vezels, zoals nylon en polyester.
- Olie- en gasindustrie: gebruikt bij het boren en winnen van olie en gas.
- Vee: Gebruikt als voedingssupplement voor vee om een gezonde groei en ontwikkeling te bevorderen.
Dit zijn slechts enkele voorbeelden van de vele toepassingen van natriumchloride. Door zijn veelzijdigheid en beschikbaarheid is het een essentieel ingrediënt in veel producten en processen in een breed scala van industrieën.
Vragen:
Vraag: Is natriumchloride een verbinding?
A: Ja, natriumchloride is een verbinding.
Vraag: Is natriumchloride ionisch of covalent?
A: Natriumchloride is een ionische verbinding.
Vraag: Wat is natriumchloride?
A: Natriumchloride is een witte kristallijne verbinding met de chemische formule NaCl. Het wordt gewoonlijk tafelzout genoemd en is essentieel voor de voeding van mens en dier.
Vraag: Waar wordt natriumchloride voor gebruikt?
A: Natriumchloride heeft veel toepassingen in verschillende industrieën en toepassingen, waaronder als smaakmaker en smaakversterker in voedingsmiddelen, als medische behandeling, bij de chemische productie, bij waterbehandeling, als ontijzingsmiddel, in textiel en aardolie. en gas, en als voedingssupplement voor vee.
Vraag: Is natriumchloride oplosbaar in water?
A: Ja, natriumchloride is zeer oplosbaar in water.
