Hydrazine of N2H4 is een kleurloze, zeer reactieve verbinding bestaande uit stikstof en waterstof. Het wordt gebruikt als raketbrandstof, in farmaceutische producten en landbouwchemicaliën, en als reductiemiddel bij chemische reacties.
| IUPAC-naam | Hydrazine |
| Moleculaire formule | N2H4 |
| CAS-nummer | 302-01-2 |
| Synoniemen | Diamine; Diazaan; Stikstofhydride; Watervrij hydrazine; Watervrij hydrazine; Hydraziniumhydroxide; Hydrazine gehydrateerd; Methylhydrazine; Symmetrische hydrazine |
| InChi | InChI=1S/H4N2/c1-2/h2H,1H2 |
Lewis-structuur N2H4:
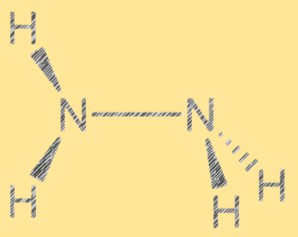
De Lewis-structuur van hydrazine toont de rangschikking van elektronen in het molecuul. De structuur bestaat uit twee stikstofatomen, elk met een paar vrije elektronen, en vier waterstofatomen. De twee stikstofatomen zijn verbonden door een enkele covalente binding en elk stikstofatoom is ook gekoppeld aan twee waterstofatomen. De Lewis-structuur van hydrazine helpt de reactiviteit en eigenschappen ervan te verklaren.
Naam van verbinding N2H4:
De naam van de verbinding N2H4 is hydrazine. De naam komt van het feit dat hydrazine een verbinding is die waterstof- en stikstofatomen bevat. Hydrazine is ook bekend onder verschillende andere namen, waaronder diamine, diazane en stikstofhydride.
Molaire massa N2H4:
De molaire massa van hydrazine, met molecuulformule N2H4, is 32,04 g/mol. Het is een relatief lichte verbinding bestaande uit twee stikstofatomen en vier waterstofatomen. De lage molaire massa van Hydrazine is een van de redenen waarom het vaak wordt gebruikt als raketbrandstof, omdat het een hoge stuwkracht-gewichtsverhouding biedt.
Kookpunt van hydrazine:
Hydrazine heeft een kookpunt van 113,5 ° C (236,3 ° F) bij atmosferische druk. Dit lage kookpunt betekent dat hydrazine gemakkelijk kan verdampen, wat het gevaarlijk kan maken om ermee om te gaan. Bij verhitting kan hydrazine ontleden in stikstofgas en waterstofgas, wat het ook gevaarlijk kan maken.
Smeltpunt van hydrazine:
Het smeltpunt van hydrazine is -51,7 ° C (-61,06 ° F). Dit betekent dat hydrazine bij kamertemperatuur en druk vloeibaar is. Het lage smeltpunt betekent ook dat het gemakkelijk kan stollen bij koudere temperaturen, waardoor het moeilijk te hanteren kan zijn.
Dichtheid van hydrazine g/ml:
De dichtheid van hydrazine is 1,00 g/ml bij kamertemperatuur en druk. Dit betekent dat hydrazine een iets hogere dichtheid heeft dan water, dat onder dezelfde omstandigheden een dichtheid heeft van 1,00 g/ml.
Molecuulgewicht van hydrazine:
Het molecuulgewicht van hydrazine is 32,04 g/mol. Deze waarde wordt gebruikt om de hoeveelheid hydrazine te berekenen die nodig is bij chemische reacties en andere toepassingen.
Structuur van hydrazine:
De structuur van hydrazine bestaat uit twee stikstofatomen die met elkaar zijn verbonden door een enkele covalente binding, waarbij elk stikstofatoom ook is gekoppeld aan twee waterstofatomen. Hierdoor krijgt hydrazine een symmetrische V-vormige moleculaire structuur. De structuur van hydrazine speelt een belangrijke rol in de reactiviteit en eigenschappen ervan.
Hydrazine-formule:
De chemische formule voor hydrazine is N2H4. Deze formule geeft aan dat hydrazine bestaat uit twee stikstofatomen en vier waterstofatomen. De formule wordt gebruikt om hydrazine weer te geven in chemische vergelijkingen en reacties.
| Verschijning | Kleurloze tot lichtgele vloeistof |
| Soortelijk gewicht | 1,00 g/ml |
| Kleur | Kleurloos |
| Geur | Ammoniak geur |
| Molaire massa | 32,04 g/mol |
| Dikte | 1,00 g/ml |
| Fusie punt | -51,7°C (-61,06°F) |
| Kookpunt | 113,5°C (236,3°F) |
| Flitspunt | 38°C (100°F) |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in ethanol, diethylether, chloroform |
| Dampdruk | 72 mmHg bij 20°C |
| Dampdichtheid | 1,0 (lucht=1) |
| pKa | 8 |
| pH | Basisch (pH > 7) |
Hydrazineveiligheid en gevaren
Hydrazine is een zeer reactieve en gevaarlijke verbinding die zorgvuldige behandeling en opslag vereist. Het is giftig en kan ernstige brandwonden veroorzaken bij contact met de huid, ogen of slijmvliezen. Inademing van hydrazinedampen kan ook irritatie van de luchtwegen en longschade veroorzaken en in extreme gevallen fataal zijn. Hydrazine is ook brandbaar en kan gemakkelijk ontbranden, vooral bij contact met bepaalde materialen zoals oxidatiemiddelen. Vanwege deze gevaren moeten passende veiligheidsmaatregelen en persoonlijke beschermingsmiddelen worden gebruikt bij het hanteren van hydrazine, en het mag alleen in goed geventileerde ruimtes worden gebruikt door gekwalificeerde professionals die de juiste veiligheidstraining hebben gevolgd.
| Gevarensymbolen | Schedel en gekruiste knekels, vlam |
| Beveiligingsbeschrijving | Alleen gebruiken in goed geventileerde ruimtes. Draag handschoenen, kleding en oog-/gezichtsbescherming. Vermijd contact met huid, ogen en kleding. Uit de buurt houden van hitte, vonken en vlammen. |
| VN-identificatienummers | VN 2030 |
| HS-code | 282510 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig bij inslikken, inademen en contact met de huid. Kan ernstige brandwonden en weefselschade veroorzaken. Langdurige blootstelling kan lever- en nierschade veroorzaken en kan mogelijk kankerverwekkend zijn. |
Hydrazinesynthesemethoden
Hydrazine kan op verschillende manieren worden gesynthetiseerd, afhankelijk van de gewenste zuiverheid en de specifieke toepassing. Enkele veel voorkomende methoden voor het synthetiseren van hydrazine zijn:
- Raschig-proces: deze methode omvat de reactie van ammoniak en natriumhypochloriet in aanwezigheid van een katalysator zoals koper of nikkel.
- Olin-Raschig-proces: dit proces omvat de reactie van ureum en zoutzuur om hydrazinehydraat te produceren.
- Ketazineproces: dit proces omvat de reactie van aceton met ammoniak in aanwezigheid van een katalysator zoals Raney-nikkel.
- Peroxideproces: Dit proces omvat de reactie van waterstofperoxide en ammoniak in aanwezigheid van een katalysator zoals platina of palladium.
- Bayer-proces: Dit proces omvat de reactie van natriumhypochloriet met ureum in aanwezigheid van een katalysator zoals koper of nikkel.
- Houben-Hoesch-reactie: Deze reactie omvat de reactie van salpeterigzuur met ammoniak in aanwezigheid van een reductiemiddel zoals zink.
Elke methode heeft zijn eigen voor- en nadelen, en de keuze van de methode zal afhangen van factoren zoals kosten, opbrengst, zuiverheid en veiligheidsoverwegingen. De synthese van hydrazine moet met voorzichtigheid worden uitgevoerd, aangezien hydrazine een gevaarlijke stof is en een risico kan vormen voor de menselijke gezondheid en veiligheid als er niet op de juiste manier mee wordt omgegaan.
Gebruik van hydrazine
N2H4 heeft een breed scala aan industriële, commerciële en militaire toepassingen vanwege zijn unieke chemische eigenschappen. Enkele veel voorkomende toepassingen van N2H4 zijn onder meer:
- Bedrijven gebruiken N2H4 als raketbrandstof vanwege de hoge energie-inhoud en stabiliteit.
- N2H4 wordt gebruikt als polymerisatiemiddel bij de productie van bepaalde polymeren, waaronder nylon en kevlar.
- Chemici gebruiken N2H4 als reductiemiddel bij chemische synthesereacties, vooral bij de productie van farmaceutische producten, pesticiden en andere organische verbindingen.
- N2H4 fungeert als reductiemiddel bij metaalplateerprocessen, vooral bij vernikkelen.
- Waterzuiveringsinstallaties gebruiken N2H4 als zuurstofvanger, vooral in ketels en koeltorens.
- Fotografen gebruiken N2H4 als fotografische ontwikkelaar, vooral bij zwart-witfotografie.
- Autofabrikanten vertrouwen op N2H4 als opblaasmechanisme in auto-airbagsystemen.
- Industrieën gebruiken N2H4 als reinigingsmiddel voor bepaalde apparatuur en oppervlakken, vooral in de elektronica-industrie.
Hoewel hydrazine veel nuttige toepassingen heeft, is het ook een gevaarlijke stof en moet er met zorg mee worden omgegaan. Bij het hanteren van hydrazine moeten de juiste veiligheidsmaatregelen en persoonlijke beschermingsmiddelen worden gebruikt, en deze mogen alleen worden gebruikt door gekwalificeerde professionals die de juiste veiligheidstraining hebben gevolgd.
Vragen:
Wat is het oxidatiegetal (oxidatietoestand) van N in N2H4?
In N2H4 is het oxidatiegetal (oxidatietoestand) van N -2. Elk waterstofatoom heeft een oxidatiegetal van +1, en aangezien N2H4 een neutraal molecuul is, moet de som van de oxidatiegetallen van alle atomen gelijk zijn aan nul. Omdat er twee stikstofatomen in N2H4 zitten, is het totale oxidatiegetal van stikstof in het molecuul -4. Daarom is het oxidatiegetal van elk stikstofatoom -2, wat de oxidatiegetallen van de waterstofatomen in evenwicht brengt.
Wat is de naam van de verbinding N2H4?
De verbinding N2H4 wordt gewoonlijk hydrazine genoemd.
Wat zijn de molaire verhoudingen van hydrazine (n2h4) tot waterstofperoxide (h2o2) en van hydrazine tot water?
De molaire verhoudingen van hydrazine (N2H4) tot waterstofperoxide (H2O2) en van hydrazine tot water kunnen worden bepaald uit de uitgebalanceerde chemische vergelijkingen van de respectieve reacties.
Wanneer hydrazine reageert met waterstofperoxide, produceert het stikstofgas (N2), water (H2O) en zuurstofgas (O2) volgens de volgende uitgebalanceerde vergelijking:
N2H4 + H2O2 → N2 + 2H2O + O2
Volgens deze vergelijking is de molaire verhouding van hydrazine tot waterstofperoxide 1:1. Dit betekent dat voor elke mol hydrazine die bij de reactie wordt gebruikt, één mol waterstofperoxide wordt verbruikt.
Wanneer hydrazine reageert met water, vormt het hydrazinehydraat, dat de chemische formule N2H4·H2O heeft. De uitgebalanceerde chemische vergelijking voor deze reactie is:
N2H4 + H2O → N2H4·H2O
Volgens deze vergelijking is de molaire verhouding hydrazine/water 1:1. Dit betekent dat voor elke mol hydrazine die bij de reactie wordt gebruikt, één mol water wordt verbruikt en één mol hydrazinehydraat wordt geproduceerd.
