Magnesiumoxide (MgO) is een witte poederachtige vaste stof die wordt gebruikt als bouwmateriaal en als voedingssupplement. Het wordt ook gebruikt als antacidum vanwege zijn basische (alkalische) eigenschappen.
| IUPAC-naam | Magnesium oxide |
| Moleculaire formule | MgO |
| CAS-nummer | 1309-48-4 |
| Synoniemen | Magnesia, Magnesiet, Periklaas |
| InChi | InChI=1S/MgO/c1-2 |
Magnesiumoxide-formule
De chemische formule voor magnesiumoxide is MgO. Het vertegenwoordigt een magnesiumion (Mg2+) en een zuurstofion (O2-). De formule geeft de verhouding aan van de elementen die in de verbinding aanwezig zijn en wordt gebruikt om uitgebalanceerde chemische vergelijkingen te schrijven voor reacties waarbij magnesiumoxide betrokken is.
Molaire massa van magnesiumoxide
De molaire massa van magnesiumoxide is 40,304 g/mol. Het wordt berekend door de atoommassa’s van elk element in de verbinding op te tellen. De atoommassa van magnesium is 24.305 g/mol, terwijl die van zuurstof 16.000 g/mol is. De molaire massa is belangrijk bij het bepalen van de hoeveelheid stof die aanwezig is in een bepaald monster magnesiumoxide.
Kookpunt van magnesiumoxide
Het kookpunt van magnesiumoxide is 2852°C. Bij deze temperatuur wordt de dampspanning van de vaste stof gelijk aan de atmosferische druk en begint deze te koken. Het hoge kookpunt van magnesiumoxide is te wijten aan zijn ionische aard, die een grote hoeveelheid energie vereist om de ionen in de roosterstructuur te scheiden.
Smeltpunt van magnesiumoxide
Het smeltpunt van magnesiumoxide is 2800°C. Bij deze temperatuur verandert de vaste stof van toestand in vloeistof. Het hoge smeltpunt van magnesiumoxide is ook te danken aan de ionische aard ervan en de sterke bindingen tussen ionen in de netwerkstructuur.
Dichtheid van magnesiumoxide g/ml
De dichtheid van magnesiumoxide is 3,58 g/ml. Deze waarde kan worden gebruikt om de hoeveelheid ruimte te bepalen die wordt ingenomen door een bepaalde massa magnesiumoxide. Het is een karakteristieke eigenschap van de verbinding en is bruikbaar in diverse toepassingen.
Magnesiumoxide molecuulgewicht
Het molecuulgewicht van magnesiumoxide is 40.304 g/mol. Het is de som van de atoomgewichten van elk element dat in de verbinding aanwezig is. Het molecuulgewicht is belangrijk bij het bepalen van de hoeveelheid stof die in een bepaald monster magnesiumoxide aanwezig is.
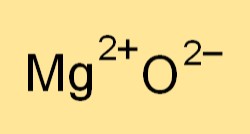
Structuur van magnesiumoxide
Magnesiumoxide heeft een kristalroosterstructuur waarin magnesiumionen omgeven zijn door zuurstofionen. Magnesium- en zuurstofionen worden bij elkaar gehouden door sterke ionische bindingen, die bijdragen aan de hoge smelt- en kookpunten van de verbinding. Kristalstructuur is een belangrijke factor bij het bepalen van de eigenschappen van magnesiumoxide, zoals de dichtheid en thermische geleidbaarheid.
| Verschijning | Witte poederachtige vaste stof |
| Soortelijk gewicht | 3,58 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 40,304 g/mol |
| Dikte | 3,58 g/ml |
| Fusie punt | 2800°C |
| Kookpunt | 2852°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in zuur |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch (basisch) |
Veiligheid en gevaren van magnesiumoxide
Magnesiumoxide wordt in de aanbevolen doseringen over het algemeen als veilig voor menselijke consumptie beschouwd en wordt gebruikt als voedingssupplement en antacidum. Het inademen van hoge concentraties magnesiumoxidestof kan echter irritatie van de luchtwegen veroorzaken en langdurige blootstelling kan tot longschade leiden. Het innemen van grote hoeveelheden magnesiumoxide kan diarree, misselijkheid en buikpijn veroorzaken. Het is belangrijk om magnesiumoxide op te slaan in een droge, goed geventileerde ruimte om het inademen van stof te voorkomen. Vermijd huid- en oogcontact met magnesiumoxide, aangezien dit irritatie kan veroorzaken. Zoals bij alle chemicaliën is het belangrijk om de juiste hanterings- en veiligheidsprocedures te volgen bij het werken met magnesiumoxide om het risico op letsel te minimaliseren.
| Gevarensymbolen | N.v.t |
| Beveiligingsbeschrijving | S26-S36/37/39 |
| VN-identificatienummers | UN3077, Milieugevaarlijke stoffen, vast, neg (magnesiumoxide) |
| HS-code | 2825.90.90 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit bij inslikken in de aanbevolen doses, kan irritatie van de luchtwegen veroorzaken bij inademing bij hoge concentraties |
Synthesemethoden voor magnesiumoxide
Magnesiumoxide (MgO) kan op verschillende manieren worden gesynthetiseerd, waaronder thermische ontleding, precipitatie en sol-gelprocessen.
Bij thermische ontleding, ook wel calcineren genoemd, wordt magnesiumcarbonaat of hydroxide bij hoge temperaturen verwarmd om MgO te produceren. Deze methode wordt vaak gebruikt bij de productie van vuurvaste materialen, maar ook bij de synthese van MgO met hoge zuiverheid voor de farmaceutische en chemische industrie.
Neerslag is een andere methode om MgO te synthetiseren. Deze methode omvat de reactie van magnesiumzouten, zoals magnesiumchloride of -sulfaat, met een alkalische oplossing, zoals natriumhydroxide of kaliumhydroxide, om MgO te vormen. Het neergeslagen MgO kan vervolgens worden gefiltreerd, gewassen en gedroogd om een zuiver product te verkrijgen.
Sol-gel-processen omvatten de hydrolyse en condensatie van magnesiumvoorlopers, zoals magnesiumalkoxiden, om MgO te vormen. Deze methode biedt het voordeel dat MgO wordt geproduceerd met een uniforme deeltjesgrootte en een goed gedefinieerde kristalstructuur, waardoor deze bruikbaar is voor toepassingen in de katalysator-, keramische en elektronische industrie.
Over het algemeen zal de methode voor het synthetiseren van MgO afhangen van de gewenste zuiverheid, deeltjesgrootte en kristalstructuur, evenals van de beoogde toepassing van het MgO-product. Ongeacht de synthesemethode is het belangrijk om de reactieomstandigheden zorgvuldig te controleren om de vorming van onzuiverheden te voorkomen en een MgO-product van hoge kwaliteit te verkrijgen.
Gebruik van magnesiumoxide
Magnesiumoxide (magnesiumoxide) heeft een breed scala aan toepassingen vanwege de chemische stabiliteit, hoge thermische geleidbaarheid en elektrische isolatie-eigenschappen. Enkele van de meest voorkomende toepassingen voor magnesiumoxide zijn:
- Magnesiumoxide (MgO) heeft een breed scala aan toepassingen vanwege de chemische stabiliteit, hoge thermische geleidbaarheid en elektrische isolatie-eigenschappen.
- De bouw- en constructie-industrie gebruikt MgO als brandwerend materiaal en bij de productie van vuurvaste materialen.
- De farmaceutische industrie gebruikt MgO als voedingssupplement en antacidum om maagzuur te neutraliseren.
- MgO dient als magnesiumbron bij de productie van andere magnesiumverbindingen, zoals magnesiumhydroxide en magnesiumcarbonaat.
- De chemische industrie gebruikt MgO als katalysator bij verschillende reacties, waaronder de productie van synthetisch rubber, kunststoffen en harsen.
- Landbouwindustrieën gebruiken MgO als bodemverbetering om de bodemvruchtbaarheid te verbeteren en essentieel magnesium voor plantengroei te leveren.
- Het vermogen van MgO om zware metalen en giftige stoffen te adsorberen, maakt het nuttig voor milieusanering.
- De keramische industrie gebruikt MgO als grondstof bij de productie van keramiek, elektrische isolatoren, vuurvaste materialen en hogetemperatuurisolatie.
- De elektronica-industrie gebruikt MgO bij de productie van elektronische apparaten zoals condensatoren en transistors vanwege de hoge diëlektrische constante en de lage verliestangens.
Over het geheel genomen is magnesiumoxide een veelzijdig materiaal dat vele toepassingen kent vanwege de unieke combinatie van chemische en fysische eigenschappen.
Vragen:
Wat beschrijft het beste een verbinding als magnesiumoxide?
Magnesiumoxide (MgO) vormt een ionische verbinding.
Metallisch magnesium doneert elektronen aan niet-metaalhoudende zuurstof, waardoor positief geladen magnesiumionen (Mg2+) en negatief geladen oxide-ionen (O2-) ontstaan. Deze ionen binden zich ionisch door sterke elektrostatische aantrekkingskracht, wat resulteert in een vaste kristalstructuur.
Ionische verbindingen vertonen hoge smelt- en kookpunten, stevigheid bij kamertemperatuur, goede elektrische geleidbaarheid in gesmolten of opgeloste toestand en onoplosbaarheid in de meeste oplosmiddelen. Deze kenmerken onderscheiden ionische verbindingen van moleculaire verbindingen, die worden gevormd door covalente binding en lagere smelt- en kookpunten, een slechte elektrische geleidbaarheid en oplosbaarheid in veel oplosmiddelen hebben.
Welke ionische verbinding wordt gebruikt als bouwmateriaal? kalksteenzout magnesiumoxide ijzeroxide
Zoute kalksteen is geen ionische verbinding, maar magnesiumoxide en ijzeroxide wel.
Magnesiumoxide (MgO) en ijzeroxide worden gebruikt als bouwmaterialen. MgO vormt brandwerende wanden en scheidingswanden en dient als component in vuurvaste materialen voor toepassingen bij hoge temperaturen. IJzeroxide, ook wel hematiet genoemd, geeft baksteen, beton en keramiek als pigment een roodbruine kleur. Hematiet fungeert ook als katalysator bij chemische reacties en dient als magnetisch materiaal in verschillende technologieën.
