Magnesiumsulfaat (sulfaat) of MgSo4 is een chemische verbinding bestaande uit magnesium, zwavel en zuurstof. Het wordt vaak medicinaal gebruikt als laxeermiddel, anticonvulsivum en om magnesiumtekort te behandelen.
| IUPAC-naam | Magnesiumsulfaat |
| Moleculaire formule | MgSO4 |
| CAS-nummer | 7487-88-9 |
| Synoniemen | Epsom-zout; Engels zout; Bitter zout; Badzout; Epsom-zout; Sal anglicum; Magnesiumsulfaatheptahydraat |
| InChi | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/u;(H2,1,2,3,4)/q+2;/p-2 |
Magnesiumsulfaatformule
De chemische formule voor magnesiumsulfaat is MgSO4. Deze formule geeft aan dat magnesiumsulfaat is samengesteld uit een magnesiumkation (Mg2+) en een sulfaatanion (SO42-). De magnesiumsulfaatformule is belangrijk bij chemische berekeningen omdat deze helpt bij het bepalen van de hoeveelheid van een stof die nodig is bij een chemische reactie.
MgSO4 molaire massa
De molaire massa van magnesiumsulfaat is 120,366 g/mol. Deze waarde wordt berekend door de atoommassa’s van één magnesiumatoom (24,305 g/mol), één zwavelatoom (32,066 g/mol) en vier zuurstofatomen (elk 15,999 g/mol) op te tellen. Molaire massa is een belangrijke parameter bij chemische berekeningen, omdat deze helpt bij het bepalen van de hoeveelheid van een stof die nodig is bij een chemische reactie.
Kookpunt van magnesiumsulfaat
Het kookpunt van magnesiumsulfaat hangt af van de toestand van de verbinding. Magnesiumsulfaat bestaat in twee vormen: watervrij en heptahydraat. De watervrije vorm heeft een hoger kookpunt van 1,124 ° C (2,055 ° F), terwijl de heptahydraatvorm een lager kookpunt heeft van 150 ° C (302 ° F). Het kookpunt van magnesiumsulfaat kan worden beïnvloed door factoren zoals druk en onzuiverheden.
Smeltpunt van magnesiumsulfaat
Het smeltpunt van magnesiumsulfaat hangt ook af van de toestand van de verbinding. De watervrije vorm heeft een hoger smeltpunt van 1,124 ° C (2,055 ° F), terwijl de heptahydraatvorm een lager smeltpunt heeft van 150 ° C (302 ° F). Het smeltpunt van magnesiumsulfaat kan ook worden beïnvloed door factoren zoals druk en onzuiverheden.
Dichtheid van magnesiumsulfaat g/ml
De dichtheid van magnesiumsulfaat varieert afhankelijk van de toestand van de verbinding. De watervrije vorm heeft een dichtheid van 2,66 g/cm³, terwijl de heptahydraatvorm een dichtheid heeft van 1,68 g/cm³. Dichtheid is een fysieke eigenschap van een stof die de hoeveelheid massa per volume-eenheid aangeeft. De dichtheid van magnesiumsulfaat kan worden gebruikt om het volume van een stof te berekenen die nodig is voor een chemische reactie.
Molecuulgewicht van magnesiumsulfaat
Het molecuulgewicht van magnesiumsulfaat is 120.366 g/mol. Deze waarde wordt berekend door de atoommassa’s van één magnesiumatoom (24,305 g/mol), één zwavelatoom (32,066 g/mol) en vier zuurstofatomen (elk 15,999 g/mol) op te tellen. Het molecuulgewicht is een belangrijke parameter bij chemische berekeningen, omdat het helpt bij het bepalen van de hoeveelheid van een stof die nodig is bij een chemische reactie.
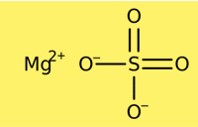
Structuur van magnesiumsulfaat
Magnesiumsulfaat heeft een kristalstructuur. De watervrije vorm heeft een rhomboëdrische kristalstructuur, terwijl de heptahydraatvorm een monokliene kristalstructuur heeft. De kristalstructuur van magnesiumsulfaat bestaat uit magnesiumkationen en sulfaatanionen. De watervrije vorm bevat één magnesiumkation en één sulfaatanion per cel, terwijl de heptahydraatvorm één magnesiumkation en twee sulfaatanionen per cel bevat.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,66 (watervrij) 1,68 (heptahydraat) |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 120.366 g/mol |
| Dikte | 2,66 g/cm³ (watervrij) 1,68 g/cm³ (heptahydraat) |
| Fusie punt | 1124°C (watervrij) 150°C (heptahydraat) |
| Kookpunt | 1124°C (watervrij) 150°C (heptahydraat) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 71,6 g/100 ml (20°C) |
| Oplosbaarheid | Oplosbaar in water en ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | 9,99 |
| pH | 6,0 – 8,0 (5% oplossing) |
Veiligheid en gevaren van magnesiumsulfaat
Magnesiumsulfaat wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld. Het kan echter bepaalde gevaren met zich meebrengen als er niet zorgvuldig mee wordt omgegaan. Blootstelling aan magnesiumsulfaatstof kan de ogen, huid en luchtwegen irriteren. Het innemen of injecteren van grote hoeveelheden magnesiumsulfaat kan diarree, maagkrampen en uitdroging veroorzaken. Het is belangrijk om beschermende uitrusting, zoals handschoenen en een veiligheidsbril, te dragen bij het hanteren van magnesiumsulfaat om irritatie van de huid en ogen te voorkomen. Indien ingeslikt of blootgesteld, dient u onmiddellijk medische hulp te zoeken. Magnesiumsulfaat moet op een koele, droge plaats worden bewaard, uit de buurt van warmtebronnen en onverenigbare materialen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S22 – Stof niet inademen; S24/25 – Vermijd contact met huid en ogen; S36 – Draag geschikte beschermende kleding; S26 – Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen; S45 – Bij een ongeval of als u zich onwel voelt, raadpleeg onmiddellijk een arts (toon hem indien mogelijk het etiket) |
| AN-identificaties | UN3077 |
| HS-code | 28332100 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) > 3.000 mg/kg; LD50 (cutaan, rat) > 2.000 mg/kg |
Methoden voor synthese van magnesiumsulfaat
Er bestaan verschillende methoden om magnesiumsulfaat (MgSO4) te synthetiseren.
Een gebruikelijke methode is om magnesiumoxide of magnesiumhydroxide te laten reageren met zwavelzuur. Het proces omvat het toevoegen van magnesiumoxide of hydroxide aan zwavelzuur onder roeren totdat het mengsel volledig oplost. Verzamel de MgSO4-magnesiumkristallen door de oplossing te verdampen om overtollig water te verwijderen.
Een andere benadering is om magnesiumcarbonaat langzaam onder roeren aan het zwavelzuur toe te voegen totdat het volledig is opgelost. Om MgSO4-magnesiumkristallen te verkrijgen, filtert u de resulterende oplossing om alle onzuiverheden te verwijderen en verdampt u deze.
Laat het magnesium reageren met zwavelzuur en verwarm het mengsel tot de reactie voltooid is. Filtreer en damp vervolgens de resulterende oplossing in om de magnesium-MgS04-kristallen te verkrijgen.
Je kunt magnesium MgSO4 ook verkrijgen door magnesiumchloride te laten reageren met natrium MgSO4. Het proces omvat het toevoegen van magnesiumchloride aan een oplossing van natrium MgSO4, het resulterende mengsel roeren en verwarmen totdat zich magnesium MgSO4-kristallen vormen.
Gebruik van magnesiumsulfaat
Magnesiumsulfaat (MgSO4) kent vele toepassingen op diverse terreinen. Enkele van de toepassingen zijn onder meer:
- Medisch gebruik: Gebruikt als behandeling voor eclampsie en pre-eclampsie tijdens de zwangerschap, en om aanvallen te voorkomen bij patiënten met ernstige astma of hypomagnesiëmie. Het dient als een zuiverend en laxerend middel.
- Landbouw: Gebruikt als meststof vanwege het hoge magnesium- en zwavelgehalte. Boeren gebruiken het om magnesiumtekorten in de bodem te corrigeren.
- Voedings- en drankenindustrie: Gebruikt als brouwzout bij de bierproductie om de waterchemie aan te passen en de smaak te verbeteren. De voedingsindustrie gebruikt het als stollingsmiddel bij de productie van tofu.
- Industriële toepassingen: Gebruikt als droog- en droogmiddel, maar ook als vlamvertrager. Verschillende industrieën gebruiken het bij de productie van textiel, papier en chemicaliën.
- Persoonlijke verzorging: Mensen gebruiken magnesiumsulfaat in badzout en voetbaden vanwege de geclaimde gezondheidsvoordelen, waaronder het verminderen van spierpijn en stijfheid.
- Andere toepassingen: Gebruikt bij de productie van pigmenten, explosieven en bij de zuivering van metalen.
Vragen:
Vraag: Wat is een basis die in tandpasta wordt gebruikt?
A: De meest gebruikte basis in tandpasta is meestal calciumcarbonaat of natriumbicarbonaat. Deze basen helpen bij het schrobben van de tanden en het verwijderen van tandplak.
Vraag: Waar wordt magnesiumsulfaat voor gebruikt?
A: Magnesiumsulfaat heeft verschillende toepassingen, waaronder als behandeling voor eclampsie en pre-eclampsie tijdens de zwangerschap, als catharsis en laxeermiddel, als meststof, als brouwzout, als brandvertrager en als droogmiddel. Het wordt ook gebruikt bij de vervaardiging van textiel, papier en chemicaliën.
Vraag: Is magnesiumsulfaat oplosbaar?
A: Magnesiumsulfaat is oplosbaar in water en alcohol.
Vraag: Is magnesiumsulfaat oplosbaar in water?
A: Ja, magnesiumsulfaat is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 25,5 g/100 ml bij kamertemperatuur.
Vraag: Waar wordt magnesiumsulfaat voor gebruikt?
A: Magnesiumsulfaat heeft verschillende toepassingen en voordelen, afhankelijk van de specifieke toepassing. Enkele toepassingen ervan zijn onder meer als medische behandeling, als meststof, als brouwzout, als brandvertrager en als droogmiddel. Medicinaal kan magnesiumsulfaat worden gebruikt om epileptische aanvallen te voorkomen, constipatie te behandelen en spierpijn en stijfheid te verminderen.
