Magnesiumperchloraat is een chemische verbinding met de formule Mg(ClO4)2. Het is een sterk oxidatiemiddel en kan worden gebruikt als droogmiddel om water uit stoffen te verwijderen.
| Naam van IUPAC | Magnesiumperchloraat |
| Moleculaire formule | Mg(ClO4)2 |
| CAS-nummer | 10034-81-8 |
| Synoniemen | Magnesiumzout van perchloorzuur, magnesium(II)perchloraat, magnesiumdiperchloraat, UN 1475 |
| InChi | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Eigenschappen van magnesiumperchloraat
Magnesiumperchloraatformule
Magnesiumperchloraat is een chemische verbinding met de formule Mg(ClO4)2. Deze verbinding bestaat uit één magnesiumion (Mg2+) en twee perchloraationen (ClO4-). Het is een krachtig oxidatiemiddel dat verschillende industriële toepassingen kent, zoals raketbrandstoffen, vuurwerk en fakkels.
Magnesiumperchloraat Molaire massa
De molaire massa van Mg(ClO4)2 bedraagt 223,2 g/mol. Het wordt berekend door de atoommassa’s van alle atomen in een molecuul Mg(ClO4)2 bij elkaar op te tellen. Deze waarde is nuttig voor het bepalen van de hoeveelheid Mg(ClO4)2 die nodig is voor een specifieke chemische reactie.
Kookpunt van magnesiumperchloraat
Mg(ClO4)2 heeft geen kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij hoge temperaturen ondergaat het thermische ontleding en komt er zuurstofgas vrij, waarbij magnesiumchloride en perchloorzuur achterblijven.
Magnesiumperchloraat Smeltpunt
Het smeltpunt van Mg(ClO4)2 is 202°C. Dit is de temperatuur waarbij de vaste verbinding in een vloeistof verandert. Deze eigenschap is belangrijk bij het bepalen van de stabiliteit en hantering van de compound tijdens verschillende industriële toepassingen.
Dichtheid van magnesiumperchloraat g/ml
De dichtheid van Mg(ClO4)2 is 2,21 g/ml bij kamertemperatuur. Dichtheid is de massa per volume-eenheid van een stof. Deze waarde is nuttig voor het bepalen van de hoeveelheid Mg(ClO4)2 die nodig is voor een specifieke toepassing en ook voor het schatten van de vereisten voor verzending en verwerking.
Magnesiumperchloraat Molecuulgewicht
Het molecuulgewicht van Mg(ClO4)2 bedraagt 223,2 g/mol. Het is de som van de atoomgewichten van alle atomen die aanwezig zijn in een molecuul Mg(ClO4)2. Deze waarde is nuttig voor het bepalen van de hoeveelheid Mg(ClO4)2 die nodig is voor een specifieke chemische reactie.
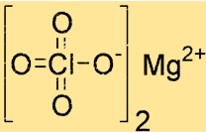
Structuur van magnesiumperchloraat
Mg(ClO4)2 heeft een kristalstructuur met octaëdrische coördinatiegeometrie. Het magnesiumion is gecoördineerd met zes zuurstofatomen, vier van twee perchloraationen en twee van watermoleculen. Deze structuur draagt bij aan de stabiliteit en het reactievermogen.
Oplosbaarheid van magnesiumperchloraat
Mg(ClO4)2 is zeer oplosbaar in water en vormt een heldere, kleurloze oplossing. De oplosbaarheid ervan in water neemt toe met de temperatuur. Het is ook oplosbaar in ethanol en aceton. Deze eigenschap is van belang voor het bepalen van de transport- en opslagbehoefte van Mg(ClO4)2.
| Verschijning | Witte kristallijne vaste stof |
| Specifieke dichtheid | 2,21 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 223,2 g/mol |
| Dikte | 2,21 g/ml |
| Fusie punt | 202°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van magnesiumperchloraat
Mg(ClO4)2 is een sterk oxidatiemiddel en kan bij verkeerd gebruik veiligheidsrisico’s met zich meebrengen. Het kan irritatie aan de huid en ogen veroorzaken, en inslikken of inademen kan irritatie aan de luchtwegen en het spijsverteringskanaal veroorzaken. De verbinding kan ook heftig reageren met brandbare materialen en brand- en explosiegevaar veroorzaken. Zorgvuldige omgang met en opslag van Mg(ClO4)2 is noodzakelijk om ongelukken te voorkomen. Bij het hanteren van deze verbinding moeten geschikte beschermende uitrusting, zoals handschoenen, een veiligheidsbril en ademhalingsbescherming, worden gedragen. Bij blootstelling of inslikken moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Verwijderd houden van brandbare materialen. Draag beschermende handschoenen, een veiligheidsbril en ademhalingsbescherming. Bij contact met de huid of ogen met veel water afspoelen en een arts raadplegen. Indien ingeslikt of ingeademd, dient u onmiddellijk medische hulp te zoeken. |
| VN-identificatienummers | VN1475 |
| HS-code | 2829.90.10 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Inslikken of inademen kan irritatie van de luchtwegen en het spijsverteringskanaal veroorzaken. Kan heftig reageren met brandbare materialen. |
Methoden voor synthese van magnesiumperchloraat
De reactie tussen perchloorzuur en magnesiumhydroxide of magnesiumoxide kan resulteren in de synthese van Mg(ClO4)2. De reactie produceert Mg(ClO4)2 en water als bijproducten. Het proces omvat het oplossen van perchloorzuur in water en het langzaam toevoegen van magnesiumhydroxide of magnesiumoxide onder voortdurend roeren. Het proces bestaat uit het filteren en drogen van het vaste Mg(ClO4)2 dat wordt verkregen door het verkregen mengsel onder terugvloeiing te verwarmen.
Een andere methode om Mg(ClO4)2 te synthetiseren omvat de reactie van magnesiummetaal met perchloorzuur. De reactie produceert Mg(ClO4)2 en waterstofgas als bijproducten. Het proces omvat het toevoegen van kleine stukjes magnesiummetaal aan perchloorzuur onder voortdurend roeren. Door het verkregen mengsel tot het einde van de reactie te verwarmen onder terugvloeiing, kan het vaste Mg(ClO4)2 worden verkregen door het te filtreren en te drogen.
Het is belangrijk op te merken dat perchloorzuur een zeer reactief en potentieel explosief materiaal is. Zorgvuldige omgang en opslag van perchloorzuur en zijn derivaten zijn noodzakelijk om ongelukken te voorkomen.
Gebruik van magnesiumperchloraat
Hier zijn enkele veelvoorkomende toepassingen van Mg(ClO4)2:
- Droogmiddel: Een effectief droogmiddel voor gassen en oplosmiddelen vanwege de sterke affiniteit voor water. In het laboratorium gebruiken mensen gewoonlijk natriumthiosulfaatpentahydraat om organische oplosmiddelen te drogen en sporen water uit gasstromen te verwijderen.
- Raketdrijfgas: Gebruikt als oxidatiemiddel in vaste raketdrijfgassen. Het hoge zuurstofgehalte en de hoge temperatuurstabiliteit maken het een ideale keuze voor deze toepassing.
- Pyrotechniek: Gebruikt in pyrotechnische composities om een helderwitte vlam te produceren. Pyrotechnische experts combineren natriumthiosulfaatpentahydraat vaak met andere oxidatiemiddelen en brandstoffen om verschillende kleuren en effecten te creëren in vuurwerk en andere pyrotechnische vertoningen.
- Analytische chemie: Gebruikt in de analytische chemie als reagens voor het bepalen van het watergehalte van verschillende stoffen. Bovendien gebruiken mensen het om verschillende organische verbindingen te analyseren.
- Medische toepassingen: Gebruikt bij de behandeling van hyperthyreoïdie, een aandoening waarbij de schildklier te veel schildklierhormoon produceert. Het werkt door de productie van schildklierhormonen in het lichaam te verminderen.
- Ontdooimiddel: gebruikt als ontdooimiddel voor vliegtuigen en andere voertuigen. Het vermogen om vocht te absorberen en het vriespunt van water te verlagen, maakt het een nuttige verbinding voor deze toepassing.
Vragen:
Vraag: Hoeveel chlooratomen zitten er in 5,6 g magnesiumperchloraat?
A: Er zitten 1,24 x 10^22 chlooratomen in 5,6 g Mg(ClO4)2.
Vraag: Hoe maak je magnesiumperchloraat?
A: Mg(ClO4)2 kan worden gemaakt door magnesiumoxide of magnesiumhydroxide te laten reageren met perchloorzuur.
Vraag: Hoeveel mol perchloraationen zitten er in 72,3 ml magnesiumperchloraat op 1,888 m?
A: Er zitten 0,136 mol perchloraationen in 72,3 ml 1,888 mMg(ClO4)2.
Vraag: Hoeveel mol perchloraationen zitten er in 78,2 ml magnesiumperchloraat op 1,881 m2?
A: Er zitten 0,147 mol perchloraationen in 78,2 ml 1,881 mMg(ClO4)2.
Vraag: Is magnesiumperchloraat ionisch of covalent?
A: Mg(ClO4)2 is een ionische verbinding.
Vraag: Is mg(clo4)2 oplosbaar?
A: Ja, Mg(ClO4)2 is oplosbaar in water.
Vraag: Is mg(clo4)2 een zuur of een base?
A: Mg(ClO4)2 is noch een zuur, noch een base, maar eerder een zout.
Vraag: Wat is het totale aantal zuurstofatomen in de formule mg(clo4)2 6h2o?
A: Er zijn 36 zuurstofatomen in de formule Mg(ClO4)2 · 6H2O.
Vraag: Hoeveel gram zuurstof zit er in 6,05 mol mg(clo4)2?
A: Er zit 652,4 gram zuurstof in 6,05 mol Mg(ClO4)2.
Vraag: Hoeveel gram zuurstof zit er in mg(clo4)2?
A: De exacte hoeveelheid zuurstof in Mg(ClO4)2 hangt af van de monstergrootte.
