Magnesiumjodide is een chemische verbinding met de formule MgI2. Het is een witte kristallijne vaste stof die goed oplosbaar is in water en alcohol. MgI2 wordt vaak gebruikt als jodiumbron bij organische synthesereacties.
| Naam van IUPAC | Magnesiumjodide |
| Moleculaire formule | MgI2 |
| CAS-nummer | 10377-58-9 |
| Synoniemen | Magnesiumdijodide, Magnesium(II)jodide, UNII-14R347R70C |
| InChi | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Eigenschappen van magnesiumjodide
Magnesiumjodide-formule
De chemische formule voor magnesiumjodide is MgI2. Deze formule geeft aan dat een molecuul magnesiumjodide bestaat uit één Mg2+ kation en twee I-anionen. De formule voor magnesiumjodide is nuttig bij het bepalen van de stoichiometrie van chemische reacties en het voorspellen van de producten van chemische reacties waarbij de verbinding betrokken is.
Magnesiumjodide Molaire massa
MgI2 heeft een molaire massa van 278.113 g/mol. Deze waarde wordt verkregen door de atoommassa van één Mg-atoom (24,305 g/mol) op te tellen bij de atoommassa van twee I-atomen (253,808 g/mol) aanwezig in een MgI2-molecuul. De molaire massa van MgI2 is een belangrijke parameter voor het bepalen van de massa van een gegeven hoeveelheid van de verbinding, nuttig in veel industriële en wetenschappelijke toepassingen.
Kookpunt van magnesiumjodide
MgI2 heeft een relatief hoog kookpunt van 1309°C. Dit geeft aan dat er een aanzienlijke hoeveelheid energie nodig is om de intermoleculaire aantrekkingskrachten tussen de Mg- en I-atomen in de verbinding te doorbreken. Het kookpunt van MgI2 maakt het geschikt voor toepassingen bij hoge temperaturen, zoals bij de productie van halfgeleiders en andere elektronische componenten.
Smeltpunt van magnesiumjodide
Het smeltpunt van MgI2 is 637°C. Bij deze temperatuur verandert het vaste MgI2 in de vloeibare toestand. Het smeltpunt van MgI2 is een belangrijke fysische eigenschap die de geschiktheid ervan voor verschillende toepassingen bepaalt. Het hoge smeltpunt maakt MgI2 bijvoorbeeld ideaal voor gebruik als vloeimiddel bij de productie van aluminiumlegeringen, waarbij het nodig is metalen samen te smelten om een homogeen mengsel te creëren.
Dichtheid van magnesiumjodide g/ml
De dichtheid van MgI2 is 4,43 g/ml. Deze waarde geeft de massa aan van de verbinding die aanwezig is in een bepaald ruimtevolume. De dichtheid van MgI2 is een belangrijke factor waarmee rekening moet worden gehouden bij het bepalen van de hoeveelheid verbinding die nodig is voor een bepaalde toepassing. De hoge dichtheid van MgI2 maakt het ook bruikbaar als afschermingsmateriaal in kernreactoren.
Magnesiumjodide Molecuulgewicht
Het molecuulgewicht van MgI2 bedraagt 278,113 g/mol. Deze waarde is de som van de atoomgewichten van de samenstellende elementen van de verbinding, Mg en I. Het molecuulgewicht van MgI2 is nuttig voor het berekenen van de stoichiometrie van chemische reacties en het bepalen van het aantal mol van de verbinding dat in een bepaald monster aanwezig is.
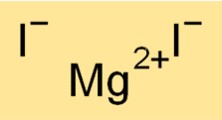
Structuur van magnesiumjodide
MgI2 heeft een kristalstructuur die behoort tot het hexagonale kristalsysteem. De structuur bestaat uit magnesiumkationen en jodide-anionen gerangschikt in een hexagonaal rooster. Mg2+-kationen bezetten het midden van de zeshoekige cellen, terwijl I-anionen de hoeken van de cellen bezetten. De kristalstructuur van MgI2 draagt bij aan de fysische en chemische eigenschappen ervan, zoals de hoge smelt- en kookpunten.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 4,43 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 278.113 g/mol |
| Dikte | 4,43 g/ml |
| Fusie punt | 637°C |
| Kookpunt | 1.309°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in alcohol, aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van magnesiumjodide
MgI2 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld en gebruikt. Zoals elke chemische verbinding kan het echter bepaalde gevaren met zich meebrengen als er niet zorgvuldig mee wordt omgegaan. MgI2 is geclassificeerd als irriterend voor de huid en de ogen, en langdurige blootstelling aan de verbinding kan huidsensibilisatie of irritatie van de luchtwegen veroorzaken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te gebruiken bij het hanteren van MgI2, inclusief handschoenen, oogbescherming en indien nodig een gasmasker. Bovendien kan MgI2 heftig reageren met water, waarbij brandbaar waterstofgas vrijkomt. Het moet daarom uit de buurt van vochtbronnen worden opgeslagen en gehanteerd.
| Gevarensymbolen | Xi: Irritant |
| Beveiligingsbeschrijving | S22: Stof niet inademen. S24: Vermijd contact met de huid. S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | UN3077 |
| HS-code | 28276000 |
| Gevarenklasse | 9: Diverse gevaarlijke goederen |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit |
Methoden voor synthese van magnesiumjodide
Er zijn verschillende methoden voor het synthetiseren van MgI2, die elk hun voordelen en beperkingen hebben.
Een gebruikelijke methode omvat de reactie van magnesiummetaal met jodium in een watervrij ether- of tetrahydrofuran (THF) oplosmiddel. Deze reactie produceert MgI2 in de vorm van een wit vast neerslag.
Een andere methode omvat de reactie van magnesiumoxide of magnesiumhydroxide met waterstofjodidezuur. Deze methode omvat doorgaans het verwarmen van magnesiumoxide of hydroxide met waterstofjodide om MgI2 te produceren.
De reactie van magnesiumcarbonaat of magnesiumoxide met waterstofjodidegas produceert ook MgI2. Deze reactie vindt doorgaans plaats bij hoge temperaturen en produceert MgI2 als een wit, vast product.
Over het geheel genomen zal de keuze van de MgI2-synthesemethode afhangen van factoren zoals de gewenste zuiverheid van het eindproduct, de beschikbaarheid van grondstoffen en de omstandigheden waaronder de synthese zal worden uitgevoerd.
Gebruik van magnesiumjodide
MgI2 heeft vele toepassingen op verschillende gebieden vanwege zijn unieke eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van MgI2:
- Als katalysator: gebruikt als katalysator bij organische chemische reacties, vooral bij de vorming van koolstof-koolstofbindingen.
- Bij de bereiding van Grignard-reagentia: Gebruikt bij de bereiding van Grignard-reagentia. Organisch chemici gebruiken Grignard-reagentia om een breed scala aan organische verbindingen te synthetiseren.
- Medicinaal: medicinaal gebruikt als supplement om het lichaam te voorzien van essentieel magnesium en jodium, belangrijk voor het behoud van gezonde lichaamsfuncties.
- In kernreactoren: gebruikt in kernreactoren als neutronenabsorbeerder om de snelheid van splijtingsreacties te beheersen.
- Fotografische verwerking: gebruikt bij fotografische verwerking als stabilisator om oxidatie en afbraak van fotografische films te voorkomen.
- Bij de productie van magnesiummetaal: wordt ook gebruikt als voorloper bij de productie van magnesiummetaal, dat een breed scala aan toepassingen in verschillende industrieën kent.
Vragen:
Vraag: Welk type ontbinding zou MgI2 ondergaan?
A: MgI2 zou ionische oplossing ondergaan vanwege zijn aard als een ionische verbinding.
Vraag: Wat is de chemische formule van magnesiumjodide?
A: De chemische formule voor magnesiumjodide is MgI2.
Vraag: Is MgI2 oplosbaar?
A: Ja, MgI2 is oplosbaar in water, alcohol en ether.
Vraag: Wat is de formule voor magnesiumjodide?
A: De formule voor magnesiumjodide is MgI2.
Vraag: Welk type verbinding is MgI2?
A: MgI2 is een ionische verbinding, gevormd door de overdracht van twee elektronen van magnesium naar jodium.
Vraag: Welke verbinding heeft de chemische formule MgI2?
A: De verbinding met de chemische formule MgI2 is magnesiumjodide.
Vraag: Wat is de naam van de verbinding met de formule MgI2?
A: De naam van de verbinding met de formule MgI2 is Magnesiumjodide.
