Magnesiumfosfaat (Mg3(PO4)2) is een verbinding bestaande uit magnesium- en fosfaationen. Het speelt een cruciale rol in veel biologische processen, zoals DNA-synthese, zenuwfunctie en spiercontractie.
| IUPAC-naam | Magnesium Fosfaat |
| Moleculaire formule | Mg3(PO4)2 |
| CAS-nummer | 7757-87-1 |
| Synoniemen | Trimagnesiumfosfaat, trimagnesiumorthofosfaat, magnesiumorthofosfaat, tertiair magnesiumfosfaat, tribasisch magnesiumfosfaat |
| InChi | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Eigenschappen van magnesiumfosfaat
Magnesiumfosfaatformule
De chemische formule voor magnesiumfosfaat is Mg3(PO4)2, wat aangeeft dat het drie Mg+2-ionen en twee PO43-ionen bevat. De formule is essentieel bij stoichiometrische berekeningen en helpt bij het bepalen van de juiste hoeveelheid reactanten en producten in chemische reacties waarbij Mg3(PO4)2 betrokken is.
Magnesiumfosfaat molaire massa
Mg3(PO4)2 heeft een molaire massa van 262,86 g/mol. Deze waarde vertegenwoordigt de massa van één mol verbinding Mg3(PO4)2, een combinatie van drie Mg+2-ionen en twee PO4-ionen. Molaire massa is een cruciale eigenschap die wordt gebruikt in stoichiometrische berekeningen om de hoeveelheid Mg3(PO4)2 te bepalen die nodig is bij verschillende chemische reacties.
Kookpunt van magnesiumfosfaat
Mg3(PO4)2 heeft geen gedefinieerd kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij hoge temperaturen valt Mg3(PO4)2 uiteen in magnesiumoxide en fosforpentoxide, die kookpunten hebben van respectievelijk 3.600°C en 300°C. De ontledingstemperatuur van Mg3(PO4)2 hangt af van verschillende factoren zoals concentratie, verwarmingssnelheid en druk.
Smeltpunt van magnesiumfosfaat
Mg3(PO4)2 heeft een smeltpunt van 1188°C. Bij deze temperatuur ondergaat de verbinding een faseverandering van vaste naar vloeibare toestand. Het smeltpunt van Mg3(PO4)2 wordt beïnvloed door verschillende factoren, waaronder druk, onzuiverheden en kristalstructuur.
Dichtheid van magnesiumfosfaat g/ml
De dichtheid van Mg3(PO4)2 varieert afhankelijk van de kristalstructuur en de omstandigheden waaronder deze wordt gemeten. De meest voorkomende vorm van Mg3(PO4)2, tri-Mg3(PO4)2, heeft een dichtheid van 2,195 g/ml. De dichtheidswaarde is essentieel voor het bepalen van de massa Mg3(PO4)2 die nodig is om een specifiek volume te bereiken in verschillende toepassingen.
Magnesiumfosfaat Molecuulgewicht
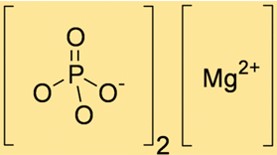
Mg3(PO4)2 heeft een molecuulgewicht van 262,86 g/mol. Deze waarde wordt berekend door de atoomgewichten van de in de verbinding aanwezige Mg- en PO43-ionen bij elkaar op te tellen. Het molecuulgewicht van Mg3(PO4)2 is nuttig bij het bepalen van de hoeveelheid Mg3(PO4)2 die nodig is bij verschillende chemische reacties.
Structuur van magnesiumfosfaat
Mg3(PO4)2 heeft een kristalstructuur die varieert afhankelijk van de bereidingswijze en omstandigheden. De meest voorkomende vorm is tri-Mg3(PO4)2, dat een kristalstructuur heeft die bestaat uit Mg+2-ionen en PO43-ionen, gerangschikt in een hexagonaal rooster. De kristalstructuur beïnvloedt de fysische en chemische eigenschappen van Mg3(PO4)2.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2.195 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 262,86 g/mol |
| Dikte | 2.195 g/ml |
| Fusie punt | 1188°C |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in zuren |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7.2 |
| pH | 8-9 (10% oplossing) |
Veiligheid en gevaren van magnesiumfosfaat
Mg3(PO4)2 wordt over het algemeen als veilig en niet-giftig beschouwd. Het is niet geclassificeerd als gevaarlijk materiaal en levert geen significante risico’s op voor de menselijke gezondheid of het milieu. Langdurige blootstelling aan hoge concentraties Mg3(PO4)2-stof kan echter irritatie van de luchtwegen veroorzaken. Inname van grote hoeveelheden Mg3(PO4)2 kan maag-darmirritatie en misselijkheid veroorzaken. Het is belangrijk om voorzichtig om te gaan met Mg3(PO4)2 en geschikte persoonlijke beschermingsmiddelen te dragen bij het hanteren van grote hoeveelheden van de verbinding. Eventuele lekkages of lekkages moeten onmiddellijk worden opgeruimd om elk risico op uitglijden of vallen te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Niet geclassificeerd als gevaarlijk |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2835.29.10 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Niet giftig bij normale concentraties |
Methoden voor synthese van magnesiumfosfaat
Verschillende methoden kunnen Mg3(PO4)2 synthetiseren, waaronder precipitatie, reactie van magnesiumoxide met fosforzuur en reactie van magnesiumhydroxide met fosforzuur.
Het precipitatieproces omvat het toevoegen van een oplosbaar fosfaatzout, zoals Na3P04, aan een oplossing die een oplosbaar Mg+2-zout bevat, zoals MgCl2 of magnesiumsulfaat. Vervolgens produceert het mengen van de twee oplossingen een neerslag van Mg3(PO4)2 dat kan worden opgevangen en gedroogd.
De reactie omvat het toevoegen van magnesiumoxide aan een oplossing van fosforzuur en het verwarmen van het mengsel om de reactie te voltooien. Het proces verzamelt en wast vervolgens het resulterende Mg3(PO4)2 om eventuele onzuiverheden te verwijderen.
De reactie omvat het toevoegen van magnesiumhydroxide aan een oplossing van fosforzuur en het verwarmen van het mengsel om het te voltooien. Verzamel vervolgens het resulterende Mg3(PO4)2 en was het grondig om alle onzuiverheden te verwijderen.
Afhankelijk van de kwaliteit van de grondstoffen en de reactieomstandigheden kunnen deze methoden worden gebruikt om Mg3(PO4)2 met verschillende zuiverheidsgraden te produceren.
Gebruik van magnesiumfosfaat
Mg3(PO4)2 heeft verschillende toepassingen in verschillende industrieën, waaronder:
- Voedingsindustrie: Gebruikt als voedingsadditief om de zuurgraad te reguleren en de textuur en kwaliteit van gebak, zuivelproducten en dranken te verbeteren.
- Landbouw: Gebruikt als meststof om planten te voorzien van essentiële voedingsstoffen zoals magnesium en fosfor.
- Farmaceutische industrie: Gebruikt als actief ingrediënt in maagzuurremmers en laxeermiddelen om de symptomen van indigestie en obstipatie te helpen verlichten.
- Waterbehandeling: Gebruikt als chemische waterbehandeling om kalkvorming in ketels en leidingen te beheersen en corrosie te voorkomen.
- Keramische industrie: Gebruikt als keramisch bindmiddel om de sterkte en duurzaamheid van keramische producten te verbeteren.
- Brandvertrager: Gebruikt als vlamvertrager in bouwmaterialen zoals isolatie, gipsplaten en gevelbeplating.
- Cosmetica: Gebruikt in cosmetica en producten voor persoonlijke verzorging als verdikkingsmiddel en emulgator.
Vragen:
Vraag: Wat is de juiste formule voor de verbinding gevormd tussen Mg+2- en PO43–ionen?
A: De juiste formule voor de verbinding gevormd tussen Mg+2-ionen en PO43-ionen is Mg3(PO4)2.
Vraag: Wat is de formule voor magnesiumfosfaat?
A: De formule voor magnesiumfosfaat is Mg3(PO4)2.
Vraag: Uit hoeveel ionen bestaat één formule-eenheid magnesiumfosfaat?
A: Eén formule-eenheid Mg3(PO4)2 bevat 11 ionen: drie Mg+2-ionen en twee PO43-ionen.
Vraag: Is magnesiumfosfaat oplosbaar?
A: Mg3(PO4)2 is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 0,1 g/100 ml bij kamertemperatuur.
Vraag: Een zuur (x) reageert met een base (y) om Mg3(PO4)2 te produceren. Wat zijn x en y?
A: Het zuur (x) is fosforzuur (H3PO4) en de base (y) is magnesiumhydroxide (Mg(OH)2).
Vraag: Wat is de molaire massa van Mg3(PO4)2, een stof die vroeger medicinaal als maagzuurremmer werd gebruikt?
A: De molaire massa van Mg3(PO4)2 is 262,86 g/mol.
Vraag: Is Mg3(PO4)2 oplosbaar in water?
A: Mg3(PO4)2 is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 0,1 g/100 ml bij kamertemperatuur.
Vraag: Hoeveel mol zuurstofatomen zitten er in één mol Mg3(PO4)2?
A: Eén mol Mg3(PO4)2 bevat 8 mol zuurstofatomen.
