Magnesiumcarbonaat (MgCO3) is een witte poederachtige substantie die vaak wordt gebruikt als maagzuurremmer en laxeermiddel. Het wordt ook aangetroffen in bepaalde cosmetica en tandpasta’s. Magnesiumcarbonaat helpt overtollig maagzuur te neutraliseren en constipatie te verlichten.
| Naam van IUPAC | Magnesiumcarbonaat |
| Moleculaire formule | MgCO3 |
| CAS-nummer | 546-93-0 |
| Synoniemen | Magnesiet, Magnesia carbonica, magnesiumzout, (MgCO3) |
| InChi | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Eigenschappen van magnesiumcarbonaat
Magnesiumcarbonaatformule
De chemische formule voor magnesiumcarbonaat is MgCO3. Deze formule geeft aan dat magnesiumcarbonaat één Mg+2-ion en één CO3 2-ion bevat. Het CO3 2-ion bestaat uit één C-atoom en drie O-atomen. De chemische formule van magnesiumcarbonaat is een belangrijke eigenschap omdat deze de samenstelling van magnesiumcarbonaat en de samenstellende elementen ervan identificeert.
Magnesiumcarbonaat Molaire massa
De molaire massa van MgCO3 is 84,31 g/mol. Deze waarde wordt verkregen door de atoommassa’s van de magnesium-, koolstof- en zuurstofatomen bij elkaar op te tellen in één mol MgCO3. Molaire massa is een belangrijke fysische eigenschap van MgCO3 omdat deze wordt gebruikt bij verschillende berekeningen, zoals het bepalen van het aantal mol MgCO3 in een bepaald monster.
Kookpunt van magnesiumcarbonaat
MgCO3 heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting ontleedt MgCO3 onder vorming van magnesiumoxide en koolstofdioxide. De ontleding van MgCO3 vindt plaats bij een temperatuur van ongeveer 350°C.
Magnesiumcarbonaat Smeltpunt
Het smeltpunt van MgCO3 is 990°C. Bij deze temperatuur smelt MgCO3 en ondergaat het ontleding om magnesiumoxide en koolstofdioxide te vormen. Het smeltpunt van MgCO3 is een belangrijke fysische eigenschap omdat het de temperatuur bepaalt waarbij MgCO3 kan worden gesmolten en verwerkt.
Dichtheid van magnesiumcarbonaat g/ml
De dichtheid van MgCO3 is 2,958 g/ml. Deze waarde wordt verkregen door de massa van één mol MgCO3 te delen door het volume. De dichtheid van MgCO3 is een belangrijke fysische eigenschap omdat deze wordt gebruikt in verschillende toepassingen, zoals het bepalen van het drijfvermogen van MgCO3 in een bepaalde oplossing.
Magnesiumcarbonaat Molecuulgewicht
Het molecuulgewicht van MgCO3 is 84,31 g/mol. Deze waarde wordt verkregen door de atoommassa’s van de magnesium-, koolstof- en zuurstofatomen in een molecuul MgCO3 op te tellen. Het molecuulgewicht van MgCO3 is een belangrijke fysische eigenschap omdat het wordt gebruikt bij verschillende berekeningen, zoals het bepalen van de hoeveelheid MgCO3 die nodig is voor een bepaalde chemische reactie.
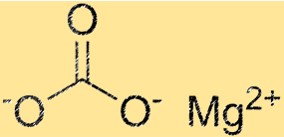
Structuur van magnesiumcarbonaat
MgCO3 heeft een trigonale kristalstructuur. Het magnesiumion bevindt zich in het midden van de structuur en is omgeven door zes carbonaationen. De carbonaationen zijn gerangschikt in een hexagonaal patroon rond het magnesiumion. De kristalstructuur van MgCO3 is een belangrijke eigenschap omdat deze de fysische en chemische eigenschappen ervan bepaalt.
| Verschijning | Witte vaste stof |
| Specifieke dichtheid | 2.958 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 84,31 g/mol |
| Dikte | 2.958 g/ml |
| Fusie punt | 990°C |
| Kookpunt | Ontleedt voordat het kookpunt wordt bereikt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 0,02 g/l (15°C) |
| Oplosbaarheid | Oplosbaar in zuren, onoplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 10.3 |
| pH | 9.2-10.2 |
Veiligheid en gevaren van magnesiumcarbonaat
MgCO3 wordt als een veilige verbinding beschouwd. Het is niet brandbaar, explosief of giftig. Maar net als elke andere chemische verbinding moet er voorzichtig mee worden omgegaan. Inademing van MgCO3-stof kan irritatie van de luchtwegen veroorzaken. Bij het hanteren van MgCO3 wordt aanbevolen om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en een veiligheidsbril. MgCO3 moet op een koele, droge plaats worden bewaard, uit de buurt van hitte- en ontstekingsbronnen. Gemorst MgCO3 moet onmiddellijk worden opgeruimd en op de juiste manier worden afgevoerd. Het is belangrijk om de juiste veiligheidsmaatregelen te volgen bij het hanteren van MgCO3 om mogelijke gevaren te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Niet geclassificeerd als gevaarlijk |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2836.60.00 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit, wordt niet beschouwd als een significant gezondheidsrisico als het op de juiste manier wordt behandeld |
Methoden voor synthese van magnesiumcarbonaat
Er zijn verschillende methoden om MgCO3 te synthetiseren, waaronder precipitatie en thermische ontleding.
Om MgCO3 te vormen met behulp van de precipitatiemethode, voeg je een oplosbaar magnesiumzout (zoals magnesiumchloride of magnesiumnitraat) toe aan een oplossing die een oplosbaar carbonaat bevat (zoals natriumcarbonaat of magnesiumnitraat). ammoniumcarbonaat). Roer vervolgens het resulterende mengsel en laat het staan. Hierdoor slaat het MgCO3 uit de oplossing neer. Filter daarna het neerslag, was het en droog het.
Om MgCO3 te verkrijgen door middel van de thermische ontledingsmethode, wordt magnesiumhydroxide of magnesiumoxide verwarmd terwijl koolstofdioxide wordt geïntroduceerd. Deze reactie leidt tot de vorming van MgCO3 en waterdamp. De volgende stap is het verzamelen, zuiveren en drogen van het MgCO3.
Een andere methode om MgCO3 te synthetiseren is het laten reageren van magnesiumsulfaat en natriumcarbonaat . Water lost de twee verbindingen op en mengt ze vervolgens, waardoor het MgCO3 uit de oplossing neerslaat. Het proces verzamelt, wast en droogt vervolgens het neerslag.
Gebruik van magnesiumcarbonaat
MgCO3 is een veelzijdige verbinding met verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Voedingssupplement: Gebruikt als voedingssupplement vanwege het vermogen om het lichaam van essentieel magnesium te voorzien.
- Antacidum: Gebruikt als antacidum om brandend maagzuur en indigestie te behandelen.
- Industriële toepassingen: Gebruikt in verschillende industriële toepassingen, zoals bij de productie van keramiek, glas en cement.
- Cosmetica: Gebruikt in cosmetica als zwellend, absorberend en ondoorschijnend middel.
- Vlamvertrager: Gebruikt als vlamvertrager in verschillende toepassingen, waaronder isolatiematerialen, textiel en kunststoffen.
- Farmaceutische producten: Gebruikt bij de productie van verschillende farmaceutische producten, zoals laxeermiddelen en maagzuurremmers.
- Voedingsindustrie: Gebruikt als voedingsadditief om de zuurgraad van voedingsproducten te reguleren en als antiklontermiddel.
- Sportuitrusting: gebruikt in sportuitrusting, zoals gymkrijt, om de grip te verbeteren en uitglijden te voorkomen.
Vragen:
Vraag: Is magnesiumcarbonaat oplosbaar in water?
A: MgCO3 heeft een lage oplosbaarheid in water. Bij kamertemperatuur kan slechts ongeveer 0,02 gram MgCO3 oplossen in 100 ml water.
Vraag: Is MgCO3 oplosbaar?
A: MgCO3 heeft een lage oplosbaarheid in water, wat betekent dat het niet erg oplosbaar is.
Vraag: Wat ontstaat er als azijnzuur en MgCO3 reageren?
A: Wanneer azijnzuur en MgCO3 reageren, vormen ze magnesiumacetaat, water en koolstofdioxide. De uitgebalanceerde chemische vergelijking voor deze reactie is MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
Vraag: De molaire oplosbaarheid van MgCO3 is 1,8 × 10–4 mol/l. Wat is Ksp voor deze verbinding?
A: Ksp-waarde voor MgCO3 met behulp van molaire oplosbaarheid:
Ksp = [Mg2+][CO32-], waarbij [Mg2+] gelijk is aan de molaire oplosbaarheid, en [CO32-] ook gelijk is aan de molaire oplosbaarheid. Daarom is Ksp = (1,8 × 10–4 mol/l)2 = 3,24 × 10–9.
Vraag: Welke van de volgende producten is een product dat wordt gevormd tijdens de ontbinding van MgCO3?
A: Wanneer MgCO3 ontleedt, vormt het magnesiumoxide (MgO) en koolstofdioxide (CO2).
Vraag: Wat is de uitgebalanceerde chemische vergelijking voor de reactie die wordt gebruikt om ΔH°f van MgCO3(s) te berekenen?
A: De uitgebalanceerde chemische vergelijking van de reactie die wordt gebruikt om de standaardvormingsenthalpie (ΔH°f) van MgCO3(s) te berekenen is: Mg(s) + CO2(g) → MgCO3(s).
