Magnesiumbromide (MgBr2) is een verbinding bestaande uit Mg en Br. Het wordt vaak gebruikt als katalysator bij organische synthesereacties en als kalmerend middel in de geneeskunde.
| IUPAC-naam | Magnesiumbromide |
| Moleculaire formule | MgBr2 |
| CAS-nummer | 7789-48-2 |
| Synoniemen | Magnesiumdibromide, UN1913, Broommagnesiet, Magnesiumbromatum, Magnesiumbromid, Magnesiumbromide |
| InChi | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
Eigenschappen van magnesiumbromide
Magnesiumbromide-formule
De chemische formule voor magnesiumbromide is MgBr2. Dit geeft aan dat MgBr2 is samengesteld uit één Mg+2-ion en twee Br-ionen. De formule vertegenwoordigt de verhouding van atomen in een molecuul en speelt een cruciale rol bij het bepalen van de eigenschappen van een verbinding. De formule voor magnesiumbromide geeft aan dat het een ionische verbinding is met een hoog smelt- en kookpunt en een sterke ionische binding tussen Mg+2 en Bri-ionen.
Molaire massa van magnesiumbromide
De molaire massa van MgBr2 is 184,113 g/mol. Het is de som van de atoommassa’s van magnesium en twee broomatomen. Molaire massa is een cruciale parameter bij chemische berekeningen, omdat deze helpt bij het bepalen van het aantal mol van een stof in een bepaalde hoeveelheid van een monster. De molaire massa van MgBr2 speelt een cruciale rol bij het bepalen van de hoeveelheid verbinding die nodig is voor chemische reacties.
Kookpunt van magnesiumbromide
MgBr2 heeft een kookpunt van 1.204 graden Celsius of 2.199 graden Fahrenheit. Het kookpunt van een verbinding is de temperatuur waarbij de dampspanning gelijk is aan de atmosferische druk. Het hoge kookpunt van MgBr2 geeft aan dat het een stabiele verbinding is die hoge temperaturen kan weerstaan zonder ontleding. Deze eigenschap maakt het bruikbaar bij toepassingen bij hoge temperaturen, zoals metallurgie en organische synthesereacties.
Smeltpunt van magnesiumbromide
MgBr2 heeft een smeltpunt van 714 graden Celsius of 1.317 graden Fahrenheit. Het smeltpunt van een verbinding is de temperatuur waarbij deze overgaat van een vaste naar een vloeibare toestand. Het hoge smeltpunt van MgBr2 geeft aan dat het een stabiele verbinding is met sterke intermoleculaire krachten. Deze eigenschap maakt het bruikbaar als reagens bij chemische reacties bij hoge temperaturen.
Dichtheid van magnesiumbromide g/ml
De dichtheid van MgBr2 is 3,72 g/ml. Dichtheid is een maatstaf voor de hoeveelheid massa per volume-eenheid van een stof. De hoge dichtheid van MgBr2 geeft aan dat het een zware verbinding is die in water kan zinken. Deze eigenschap maakt het bruikbaar bij verschillende toepassingen, zoals anorganische synthese en als kalmerend middel in de geneeskunde.
Magnesiumbromide Molecuulgewicht
Het molecuulgewicht van MgBr2 is 184,113 g/mol. Het is de som van de atoommassa’s van magnesium en twee broomatomen. Het molecuulgewicht speelt een cruciale rol bij het bepalen van de chemische en fysische eigenschappen van een verbinding. Het molecuulgewicht van MgBr2 beïnvloedt de reactiviteit en oplosbaarheid ervan in verschillende oplosmiddelen.
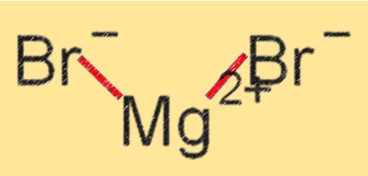
Structuur van magnesiumbromide
MgBr2 heeft een kristalroosterstructuur waarbij de Mg+2 en Br-ionen bij elkaar worden gehouden door ionische bindingen. Het is een witte kristallijne vaste stof die zeer goed oplosbaar is in water en andere polaire oplosmiddelen. De kristalroosterstructuur van MgBr2 draagt bij aan de hoge smelt- en kookpunten, evenals aan de stabiliteit ervan bij verschillende chemische reacties.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 3,72 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 184.113 g/mol |
| Dikte | 3,72 g/ml |
| Fusie punt | 714°C (1.317°F) |
| Kookpunt | 1204°C (2199°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, ethanol, aceton en ether |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Veiligheid en gevaren van magnesiumbromide
MgBr2 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld. Zoals elke chemische verbinding kan het echter gevaren opleveren als er niet zorgvuldig mee wordt omgegaan. MgBr2 is bijtend en kan ernstige huid- en oogirritatie veroorzaken. Inademing van MgBr2-stof of -dampen kan irritatie van de luchtwegen veroorzaken. Het is belangrijk om beschermende kleding en ademhalingsapparatuur te dragen bij het hanteren van MgBr2. MgBr2 kan ook heftig reageren met bepaalde chemicaliën, zoals water of zuren, waarbij waterstofbromidegas ontstaat. Daarom is het van cruciaal belang om MgBr2 uit de buurt van onverenigbare stoffen en in een goed geventileerde ruimte op te slaan en te hanteren.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag beschermende kleding en ademhalingsapparatuur. Hanteer en bewaar uit de buurt van onverenigbare stoffen. |
| VN-identificatienummers | UN2920 |
| HS-code | 2827.59.90 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Lage toxiciteit bij correct gebruik. Kan huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van magnesiumbromide
MgBr2 kan op verschillende manieren worden gesynthetiseerd.
Een gebruikelijke methode is de reactie tussen metallisch magnesium en waterstofbromidegas . Bij dit proces wordt waterstofbromidegas over Mg-metaal geleid, waarbij MgBr2 en waterstofgas worden geproduceerd.
Een andere methode is de reactie tussen magnesiumoxide of magnesiumhydroxide en broomwaterstofzuur . Dit proces produceert MgBr2 en water als producten.
Bovendien kan MgBr2 worden gesynthetiseerd door de reactie tussen magnesiumcarbonaat en broomwaterstofzuur , of door de reactie tussen magnesiumsulfaat en NaBr.
Deze methoden omvatten het mengen van de reagentia en het laten verlopen van de reactie, resulterend in de vorming van MgBr2.
Gebruik van magnesiumbromide
MgBr2 heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Bij organische synthese: gebruikt als Lewis-zuurkatalysator bij organische synthesereacties, zoals de Grignard-reactie, waarbij koolstof-koolstofbindingen worden gevormd.
- Bij de productie van vlamvertragers: Vlamvertragers, die materialen minder ontvlambaar maken, vertrouwen erop als een cruciaal onderdeel in hun productie.
- In de olie- en gasindustrie: Wordt gebruikt als voltooiingsvloeistof in olie- en gasbronnen, wat helpt de druk op peil te houden en instorting van de put te voorkomen.
- In farmaceutische producten: gebruikt als actief ingrediënt in sommige farmaceutische producten, zoals kalmerende middelen en anticonvulsiva.
- In de elektrochemie: gebruikt als elektrolyt in batterijen en andere elektrochemische apparaten.
- Bij de metaalproductie: gebruikt als vloeimiddel bij de productie van bepaalde metalen, zoals aluminium en titanium.
- In de analytische chemie: Gebruikt als reagens in de analytische chemie voor de bepaling van verschillende elementen, zoals boor en fluoride.
Vragen:
Vraag: Wat is de chemische formule van magnesiumbromide?
A: De chemische formule voor magnesiumbromide is MgBr2.
Vraag: Is magnesiumbromide ionisch of covalent?
A: MgBr2 is een ionische verbinding.
Vraag: Wat is de formule voor magnesiumbromide?
A: De formule voor magnesiumbromide is MgBr2.
Vraag: Is magnesiumbromide oplosbaar in water?
A: Ja, MgBr2 is oplosbaar in water. Het is zeer oplosbaar in water en kan oplossen om een heldere, kleurloze oplossing te vormen.
Vraag: Wat is de formule voor magnesiumbromide?
A: De formule voor magnesiumbromide is MgBr2.
