Magnesiumbisulfiet (Mg(HSO3)2) is een chemische verbinding bestaande uit magnesium, zwavel en zuurstof. Het wordt veel gebruikt in de voedingsindustrie als conserveermiddel en antioxidant om bederf en verkleuring te voorkomen.
| IUPAC-naam | Magnesiumwaterstofsulfiet |
| Moleculaire formule | Mg(HSO3)2 |
| CAS-nummer | 13774-25-9 |
| Synoniemen | Magnesiumbisulfiet; Magnesiumwaterstofsulfiet; Magnesiabisulfiet |
| InChi | InChI=1S/2H2O3S.Mg/c2 1-4(2)3;/h2 (H2,1,2,3);/q;;+2/p-2 |
Eigenschappen van magnesiumbisulfiet
Magnesiumbisulfietformule
De chemische formule voor magnesiumbisulfiet is Mg(HSO3)2. De formule vertegenwoordigt het aantal atomen van elk element dat aanwezig is in een molecuul van de verbinding. De formule voor magnesiumbisulfiet is essentieel voor het bepalen van de chemische reacties die de verbinding kan ondergaan.
Molaire massa van magnesiumbisulfiet
Mg(HSO3)2 heeft een molaire massa van 186,45 g/mol. Deze waarde vertegenwoordigt het gewicht van één mol van de verbinding in grammen. De molaire massa van een verbinding is essentieel om te bepalen hoeveel van een stof nodig is om chemische reacties uit te voeren. De molaire massa van Mg(HSO3)2 wordt berekend door de atoomgewichten van elk element in de verbinding op te tellen. Magnesium heeft een atoomgewicht van 24,305 g/mol, zwavel heeft een atoomgewicht van 32,06 g/mol en zuurstof heeft een atoomgewicht van 15,999 g/mol.
Kookpunt van magnesiumbisulfiet
Mg(HSO3)2 heeft geen kookpunt omdat het ontleedt bij verhitting. Bij verhitting in aanwezigheid van een zuur kan het echter zwaveldioxide en zwaveltrioxide vrijgeven. Deze gassen kunnen de luchtwegen irriteren en bij inademing ernstige gevolgen voor de gezondheid veroorzaken. Het is daarom essentieel om zorgvuldig om te gaan met Mg(HSO3)2 en de veiligheidsmaatregelen te volgen bij gebruik ervan in industriële processen.
Magnesiumbisulfiet Smeltpunt
Mg(HSO3)2 heeft een smeltpunt van 110°C. Deze waarde vertegenwoordigt de temperatuur waarbij de verbinding verandert van vaste naar vloeibare toestand. Mg(HSO3)2 heeft een laag smeltpunt, waardoor het gemakkelijk te smelten is en in diverse industriële processen te gebruiken is. Het kan echter bij hoge temperaturen ontleden, waardoor schadelijke gassen vrijkomen.
Dichtheid van magnesiumbisulfiet g/ml
Mg(HSO3)2 heeft een dichtheid van 2,35 g/ml. Deze waarde vertegenwoordigt de hoeveelheid massa in grammen die aanwezig is in één milliliter van de verbinding. De dichtheid van Mg(HSO3)2 is groter dan die van water, dat een dichtheid heeft van 1 g/ml. De hoge dichtheid van Mg(HSO3)2 maakt het bruikbaar in diverse toepassingen, onder meer als conserveermiddel en antioxidant in de voedingsindustrie.
Magnesiumbisulfiet Molecuulgewicht
Mg(HSO3)2 heeft een molecuulgewicht van 186,45 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen in de verbinding. Het molecuulgewicht van Mg(HSO3)2 is essentieel voor het bepalen van de hoeveelheid verbinding die nodig is om chemische reacties uit te voeren.
Structuur van magnesiumbisulfiet
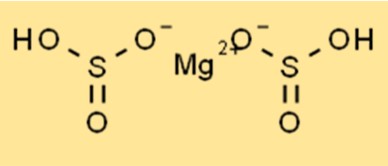
Mg(HSO3)2 heeft een kristalstructuur en behoort tot het orthorhombische kristalsysteem. De verbinding bestaat uit magnesiumkationen (Mg2+) en bisulfietanionen (HSO3-). Bisulfietanionen zijn tetraëdrisch van vorm, terwijl magnesiumkationen octaëdrisch van vorm zijn. De kristalstructuur van Mg(HSO3)2 maakt het stabiel en maakt het mogelijk om het in diverse toepassingen te gebruiken, onder meer als conserveermiddel voor levensmiddelen.
Oplosbaarheid van magnesiumbisulfiet
Mg(HSO3)2 is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 64 g/100 ml bij 20°C. Het is ook oplosbaar in methanol, maar onoplosbaar in de meeste organische oplosmiddelen. De oplosbaarheid van Mg(HSO3)2 kan variëren afhankelijk van factoren zoals temperatuur en pH.
| Verschijning | wit poeder |
| Soortelijk gewicht | 2,35 g/cm3 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 186,45 g/mol |
| Dikte | 2,35 g/ml |
| Fusie punt | 110°C |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water en ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1,91 |
| pH | 4,5 – 5,5 |
Veiligheid en gevaren van magnesiumbisulfiet
Mg(HSO3)2 kan verschillende gezondheids- en veiligheidsrisico’s met zich meebrengen als er niet met zorg mee wordt omgegaan. Bij verhitting of blootstelling aan zure omstandigheden kunnen zwaveldioxide- en zwaveltrioxidegassen vrijkomen. Deze gassen kunnen bij inademing irritatie van de luchtwegen, hoesten en kortademigheid veroorzaken. Mg(HSO3)2 kan bij contact ook huidirritatie en roodheid veroorzaken. Het is essentieel om beschermende kleding en uitrusting te dragen, zoals handschoenen en een veiligheidsbril, bij het hanteren van Mg(HSO3)2. Bovendien moet het op een koele, droge plaats worden bewaard, uit de buurt van warmtebronnen en onverenigbare materialen. Juiste hanterings- en opslagprocedures kunnen het risico op gevaren die verband houden met Mg(HSO3)2 minimaliseren.
| Gevarensymbolen | Xi: Irritant |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag beschermende kleding en uitrusting. Verwijderd houden van hitte en onverenigbare materialen. |
| VN-identificatienummers | VN 2693 |
| HS-code | 2831.10.00 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | III |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Schadelijk bij inademing of inslikken. Kan irritatie van de luchtwegen en hoesten veroorzaken. |
Methoden voor synthese van magnesiumbisulfiet
Mg(HSO3)2 kan op verschillende manieren worden gesynthetiseerd, waaronder:
- Reactie van magnesiumhydroxide met zwaveldioxide: Bij de reactie van magnesiumhydroxide met zwaveldioxide reageren de twee stoffen om Mg(HSO3)2 en water te produceren.
- Directe reactie van magnesiumoxide met zwaveldioxide: Bij hoge temperaturen reageert zwaveldioxidegas direct met magnesiumoxide om Mg(HSO3)2 en zuurstof te produceren.
- Reactie van magnesiumsulfaat met zwaveldioxide: In aanwezigheid van een reductiemiddel reageert magnesiumsulfaat met zwaveldioxidegas, wat resulteert in de productie van Mg(HSO3)2.
- Magnesiumcarbonaat met zwaveldioxide: De reactie tussen magnesiumcarbonaat en zwaveldioxidegas produceert Mg(HSO3)2 en kooldioxide.
- Reactie van magnesiumoxide met zwavelzuur en zwaveldioxide: Bij het reageren van magnesiumoxide met zwavelzuur en zwaveldioxidegas produceert de reactie Mg (HSO3) 2 en water.
Gebruik van magnesiumbisulfiet
Mg(HSO3)2 heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen:
- Voedings- en drankenindustrie: Gebruikt als conserveermiddel in de voedingsmiddelen- en drankenindustrie om oxidatie en microbiële groei te voorkomen. Het wordt vaak gebruikt in vruchtensappen, wijn en bier.
- Waterbehandeling: Gebruikt bij waterbehandeling als reductiemiddel om chloor en andere oxidatiemiddelen te verwijderen. Het is effectief bij het beheersen van de geur en smaak van water.
- Textielindustrie: Gebruikt als bleekmiddel in de textielindustrie. Het is effectief bij het verwijderen van vlekken en het verbeteren van de kleur van stoffen.
- Farmaceutische industrie: Gebruikt als reductiemiddel in de farmaceutische industrie. Het wordt gebruikt om nitrogroepen om te zetten in aminogroepen in verschillende medicijnmoleculen.
- Pulp- en papierindustrie: Gebruikt in de pulp- en papierindustrie als bleekmiddel. Het is effectief bij het verwijderen van lignine uit houtpulp en het verbeteren van de papierglans.
- Landbouw: Gebruikt in de landbouw als bodemverbetering om magnesiumtekorten in de bodem te corrigeren. Het wordt ook gebruikt als bladmeststof om de plantengroei en opbrengst te verbeteren.
Vragen:
Vraag: Wat zijn de thermodynamische eigenschappen van magnesiumbisulfiet?
A: De thermodynamische eigenschappen van Mg(HSO3)2 omvatten het kookpunt van 250°C, het smeltpunt van 70-72°C en de dichtheid van 1,84 g/ml.
Vraag: Wat is de chemische formule van magnesiumbisulfiet?
A: De chemische formule voor magnesiumbisulfiet is Mg(HSO3)2.
Vraag: Waar kan ik magnesiumbisulfiet kopen?
A: Mg(HSO3)2 kan worden gekocht bij verschillende chemische leveranciers en distributeurs. Het is algemeen verkrijgbaar in grote en kleine hoeveelheden. Sommige online platforms zoals Sigma Aldrich, Fisher Scientific en VWR International bieden Mg(HSO3)2 ook te koop aan. Het is belangrijk om ervoor te zorgen dat de leverancier een goede reputatie heeft en dat het product voldoet aan de normen die vereist zijn voor de beoogde toepassing.
