Magnesiumacetaat (Mg(C2H3O2)2) is een verbinding bestaande uit Mg2+- en C2H3O2–ionen. Het wordt vaak gebruikt als droogmiddel bij organische synthese en als voedingsadditief.
| IUPAC-naam | Magnesiumacetaat |
| Moleculaire formule | Mg(C2H3O2)2 |
| CAS-nummer | 142-72-3 |
| Synoniemen | Magnesiumdiacetaat, magnesiumzout van azijnzuur, magnesiumethanoaat, CAS 73567-85-6, EINECS 240-882-6, UNII-RS92S4G29A |
| InChi | InChI=1S/2C2H4O2.Mg/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van magnesiumacetaat
Magnesiumacetaatformule
De chemische formule voor magnesiumacetaat is Mg(C2H3O2)2. Deze formule vertegenwoordigt de samenstelling van de verbinding, met één Mg2+-ion en twee C2H3O2-. De formule is belangrijk bij het bepalen van de hoeveelheid verbinding die nodig is voor een bepaalde reactie. Het is ook nuttig voor het identificeren van de verbinding in verschillende contexten.
Molaire massa van magnesiumacetaat
De molaire massa van Mg(C2H3O2)2 bedraagt 142,39 g/mol. Deze waarde wordt verkregen door de atoommassa’s van de Mg2+ (24,31 g/mol) en C2H3O2- (58,08 g/mol) ionen op te tellen. Molaire massa is een belangrijke eigenschap bij het bepalen van de hoeveelheid Mg(C2H3O2)2 die nodig is voor een bepaalde reactie.
Kookpunt van magnesiumacetaat
Mg(C2H3O2)2 heeft een relatief hoog kookpunt van 117,5°C (243,5°F). Deze eigenschap is te wijten aan de ionische aard van de verbinding en de sterke elektrostatische aantrekkingskracht tussen de magnesium- en acetaationen. Bij deze temperatuur begint de verbinding te verdampen, maar blijft in vloeibare toestand, tenzij deze wordt blootgesteld aan hogere temperaturen.
Magnesiumacetaat Smeltpunt
Het smeltpunt van Mg(C2H3O2)2 is 160°C (320°F). Deze waarde wordt verkregen door de verbinding te verwarmen totdat deze verandert van een vaste stof in een vloeistof. Het smeltpunt is een belangrijke eigenschap die de temperatuur bepaalt waarbij de verbinding van een vaste naar een vloeibare toestand zal veranderen. Deze eigenschap is essentieel voor een goede hantering en opslag van de compound.
Dichtheid van magnesiumacetaat g/ml
De dichtheid van Mg(C2H3O2)2 bedraagt 1,45 g/ml. Deze waarde wordt verkregen door de massa van de verbinding te delen door het volume. Dichtheid is een belangrijke eigenschap die de massa van een bepaald volume van de verbinding bepaalt. Het is ook een nuttige eigenschap voor het bepalen van de zuiverheid van de verbinding, aangezien onzuiverheden de dichtheid kunnen beïnvloeden.
Magnesiumacetaat Molecuulgewicht
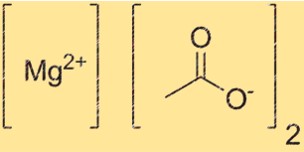
Het molecuulgewicht van Mg(C2H3O2)2 bedraagt 142,39 g/mol. Deze waarde wordt verkregen door de atoommassa’s van magnesium en twee acetaationen op te tellen. Het molecuulgewicht is een belangrijke eigenschap die de hoeveelheid van een verbinding bepaalt die nodig is voor een bepaalde reactie. Het is ook nuttig bij het bepalen van de zuiverheid van de verbinding.
Structuur van magnesiumacetaat
Mg(C2H3O2)2 heeft een ionische structuur waarin de Mg2+ kationen omgeven zijn door twee C2H3O2 anionen. Het Mg2+ kation heeft een lading van +2, terwijl het C2H3O2-anion een lading heeft van -1. De structuur wordt bij elkaar gehouden door elektrostatische aantrekking tussen tegengesteld geladen ionen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,45 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 142,39 g/mol |
| Dikte | 1,45 g/ml |
| Fusie punt | 160°C (320°F) |
| Kookpunt | 117,5°C (243,5°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol, methanol, aceton |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | 4,76 |
| pH | 7,5 – 9,0 |
Veiligheid en gevaren van magnesiumacetaat
Mg(C2H3O2)2 wordt over het algemeen als veilig beschouwd voor gebruik in de beoogde toepassingen, maar net als bij elke chemische verbinding zijn er enkele potentiële gevaren waar u rekening mee moet houden. Het kan de huid, ogen en luchtwegen irriteren bij inademing of inslikken. Langdurige of herhaalde blootstelling kan ernstigere gevolgen voor de gezondheid veroorzaken. Er moet met zorg worden omgegaan met Mg(C2H3O2)2 en er moeten passende beschermende maatregelen worden genomen bij het hanteren van deze verbinding. Het is ook belangrijk om de juiste opslag- en verwijderingsprotocollen te volgen om accidentele blootstelling of milieuschade te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S22 – Stof niet inademen; S24/25 – Vermijd contact met huid en ogen; S36/37/39 – Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming; S45 – Bij een ongeval of als u zich onwel voelt, raadpleeg onmiddellijk een arts (toon hem indien mogelijk het etiket) |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 29152900 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit, maar kan de huid, ogen en luchtwegen irriteren als er niet op de juiste manier mee wordt omgegaan |
Synthesemethoden voor magnesiumacetaat
Synthetiseer Mg(C2H3O2)2 met behulp van verschillende methoden, waaronder het laten reageren van magnesiumoxide of magnesiumhydroxide met azijnzuur .
Voeg volgens een gebruikelijke methode magnesiumoxide toe aan een oplossing van azijnzuur om Mg(C2H3O2)2 en water te vormen. Filtreer de resulterende oplossing en damp deze in om een vast product Mg(C2H3O2)2 te verkrijgen.
Een andere methode omvat de reactie van magnesiummetaal met azijnzuur in aanwezigheid van een katalysator, zoals koperchloride of kopersulfaat. De reactie produceert Mg(C2H3O2)2, waterstofgas en metallisch koper als bijproduct.
Synthetiseer Mg(C2H3O2)2 via een metathesereactie door magnesiumchloride te laten reageren met natriumacetaat in aanwezigheid van water om Mg(C2H3O2)2 en natriumchloride te produceren.
Over het algemeen hangt de keuze van de synthesemethode af van factoren zoals de gewenste zuiverheid van het Mg(C2H3O2)2-product, de beschikbaarheid van grondstoffen en de schaal van het productieproces.
Gebruik van magnesiumacetaat
Mg(C2H3O2)2 heeft vanwege zijn unieke eigenschappen een breed scala aan toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van Mg(C2H3O2)2:
- Voedseladditieven: Gebruikt als voedseladditieven om de voedingswaarde van voedingsmiddelen te verbeteren en bederf te voorkomen.
- Geneeskunde: Medicinaal gebruikt als bron van magnesium, een essentieel mineraal dat een sleutelrol speelt in veel fysiologische processen.
- Textiel: Wordt in de textielindustrie gebruikt als bijtmiddel, een stof die kleurstoffen op stoffen helpt fixeren.
- Waterbehandeling: Gebruikt in waterbehandelingstoepassingen om onzuiverheden uit water te verwijderen en kalkaanslag in leidingen en apparatuur te voorkomen.
- Beton: Gebruikt bij de productie van beton om de sterkte en duurzaamheid ervan te verbeteren.
- Chemische synthese: gebruikt als grondstof voor de synthese van andere chemische verbindingen, zoals farmaceutische producten, smaakstoffen en parfums.
Vragen:
Vraag: Wat ontstaat er als azijnzuur en magnesiumcarbonaat reageren?
A: Wanneer azijnzuur en magnesiumcarbonaat reageren, worden Mg(C2H3O2)2, kooldioxide en water gevormd.
Vraag: Waar kan ik calciummagnesiumacetaat kopen?
A: Calcium Mg(C2H3O2)2 kan worden gekocht bij verschillende chemische leveranciers en online marktplaatsen.
Vraag: Is magnesiumacetaat wateroplosbaar?
A: Ja, Mg(C2H3O2)2 is oplosbaar in water, met een oplosbaarheid van ongeveer 54 g/L bij kamertemperatuur.
Vraag: Wat is de molaire concentratie van een oplossing van 5,00 liter die 0,800 mol magnesiumacetaat bevat?
A: De molaire concentratie van een oplossing van 5,00 liter die 0,800 mol Mg(C2H3O2)2 bevat, is 0,160 M.
