Loodoxide (PbO) is een verbinding gemaakt van lood en zuurstof. Het wordt gebruikt bij de productie van batterijen, keramiek en glas vanwege zijn onderscheidende eigenschappen en toepassingen.
| IUPAC-naam | Lood(II)oxide |
| Moleculaire formule | PbO |
| CAS-nummer | 1317/36/8 |
| Synoniemen | Loodmonoxide, lood(II)oxide, litharge |
| InChi | InChI=1S/2O.Pb |
Eigenschappen van loodoxide
Loodoxideformule
De chemische formule voor loodmonoxide is PbO. Het bestaat uit een loodatoom (Pb) en een zuurstofatoom (O), wat resulteert in een eenvoudige, goed gedefinieerde moleculaire structuur.
Molaire massa van loodoxide
De molaire massa van loodmonoxide (PbO) is ongeveer 223,2 gram per mol (g/mol). Deze waarde wordt verkregen door de atoommassa’s van een loodatoom en een zuurstofatoom op te tellen.
Kookpunt van loodoxide
Loodmonoxide heeft geen duidelijk kookpunt omdat het ontleding ondergaat voordat het zijn kookpunt bereikt. Bij verhitting verandert het in metallisch lood en zuurstofgas.
Smeltpunt van loodoxide
Het smeltpunt van loodmonoxide (PbO) is ongeveer 888°C (1.630°F). Bij deze temperatuur verandert vast loodmonoxide in een gesmolten vloeistof, wat verschillende industriële toepassingen mogelijk maakt.
Loodoxidedichtheid g/ml
Loodmonoxide heeft een dichtheid van ongeveer 9,53 gram per milliliter (g/ml). Deze hoge dichtheid maakt het bruikbaar in verschillende industrieën, zoals de productie van keramiek en glas.
Molecuulgewicht van loodoxide
Het molecuulgewicht van loodmonoxide (PbO) is 223,2 g/mol. Deze waarde vertegenwoordigt de som van de atoommassa’s van lood en zuurstof in één enkel molecuul loodmonoxide.
Structuur van loodoxide
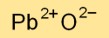
Loodmonoxide heeft een kristalroosterstructuur, waarbij loodkationen (Pb2+) posities op het rooster innemen en oxide-anionen (O2-) de interstitiële ruimtes vullen. Deze opstelling resulteert in een stabiele ionische binding.
Oplosbaarheid van loodoxide
Loodmonoxide (PbO) is slecht oplosbaar in water. Het lost slechts weinig op in water en vormt een basische oplossing door de hydrolyse van loodkationen. De oplosbaarheid ervan kan toenemen in zure omgevingen.
| Verschijning | Geel of rood poeder |
| Soortelijk gewicht | 9,53 g/ml |
| Kleur | Geel of rood |
| Geur | Geurloos |
| Molaire massa | 223,2 g/mol |
| Dikte | 9,53 g/cm³ |
| Fusie punt | 888°C (1630°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar |
| Oplosbaarheid | Lage oplosbaarheid, kan toenemen in zure omgevingen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Basisch (in waterige oplossing) |
Veiligheid en gevaren van loodoxide
Loodmonoxide brengt potentiële veiligheidsrisico’s met zich mee en vereist een zorgvuldige omgang. Inademing of inname van loodmonoxidestof of -damp kan leiden tot loodvergiftiging, met negatieve gevolgen voor het zenuwstelsel en de organen. Adequate ventilatie en persoonlijke beschermingsmiddelen zijn essentieel bij het hanteren van deze verbinding. Vermijd contact met ogen, huid of kleding om irritatie te voorkomen. Bovendien is loodmonoxide schadelijk voor het waterleven en het milieu; de lozing ervan in waterlichamen moet strikt worden vermeden. Om de risico’s te minimaliseren moeten de juiste opslag- en verwijderingsmethoden worden gevolgd. Volg altijd de veiligheidsinstructies en wettelijke maatregelen wanneer u met loodmonoxide werkt.
| Gevarensymbolen | Gezondheidsrisico |
| Beveiligingsbeschrijving | – Inademing of inslikken kan loodvergiftiging en orgaanschade veroorzaken. – Vermijd contact met ogen en huid om irritatie te voorkomen. – Hanteren met voldoende ventilatie en persoonlijke beschermingsmiddelen. Voorkom lozing in het milieu. Volg de veiligheidsinstructies. |
| VN-identificatienummers | UN3077 |
| HS-code | 2824.90.7000 |
| Gevarenklasse | 9 (Diverse gevaarlijke materialen en voorwerpen) |
| Verpakkingsgroep | III |
| Toxiciteit | Giftig voor in het water levende organismen, met langdurige gevolgen. |
Loodoxidesynthesemethoden
De synthese van loodmonoxide omvat verschillende methoden. Een veel voorkomende aanpak omvat de thermische ontleding van loodnitraat, waarbij we het loodnitraat (Pb(NO3)2) tot een specifieke temperatuur verwarmen. Dit proces breekt loodnitraat af in loodmonoxide (PbO), stikstofdioxide (NO2) en zuurstofgas (O2). De chemische reactie vertegenwoordigt:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Een andere methode omvat de oxidatie van metallisch lood. Metaallood reageert met zuurstof en produceert loodmonoxide:
2 Pb + O2 → 2 PbO
Bovendien produceert het blootstellen van lood aan corrosie onder zure omstandigheden loodmonoxide. In dit scenario reageert lood met zuurstof en water om loodmonoxide te produceren:
2 Pb + 2 H2O + O2 → 2 PbO + 2 H2O
Deze methoden zijn cruciaal voor de productie van loodmonoxide voor verschillende toepassingen, zoals de productie van batterijen, keramiek en pigmenten. Het is echter essentieel om voorzichtig om te gaan met loodverbindingen vanwege de potentiële gezondheids- en milieurisico’s ervan.
Gebruik van loodoxide
Loodmonoxide vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn de gebruikelijke toepassingen:
- Keramiek: Het fungeert als een stroom in de keramische productie en verbetert de smelteigenschappen en de algehele kwaliteit van keramische materialen.
- Stralingsbescherming: De hoge dichtheid en efficiëntie bij het absorberen van straling maken loodmonoxide tot een geschikt materiaal voor stralingsbescherming in medische faciliteiten en nucleaire industrieën.
- PVC-stabilisator: Het fungeert als hittestabilisator en smeermiddel bij de verwerking van polyvinylchloride (PVC) en helpt bij de vervaardiging van PVC-buizen, kabels en andere producten.
- Halfgeleiderapparaten: Het dient als materiaal in sommige halfgeleiderapparaten, zoals loodmonoxidevaristors, die worden gebruikt voor overspanningsbeveiliging.
- Loodzuuraccu’s: Loodzuuraccu’s gebruiken loodmonoxide als een essentieel onderdeel, waardoor ze de eigenschappen krijgen die nodig zijn voor gebruik in voertuigen, back-upvoedingen en ononderbroken stroombronnen.
- Glasproductie: Loodmonoxide speelt een cruciale rol bij de productie van loodglas, waardoor het een verhoogde brekingsindex en glans krijgt, waardoor het bij uitstek geschikt is voor decoratieve en optische doeleinden.
- Pigmenttoepassing: Verven en coatings profiteren van verschillende loodgebaseerde pigmenten, zoals minium (Pb3O4), vanwege hun levendige kleuren en weersbestendigheid.
- Gebruik in de rubberindustrie: De rubberindustrie gebruikt loodmonoxide als versneller en vulkanisatiemiddel, waardoor de eigenschappen en duurzaamheid van rubberproducten effectief worden verbeterd.
Hoewel loodmonoxide belangrijke industriële toepassingen heeft, is het essentieel om er voorzichtig mee om te gaan vanwege de potentiële gezondheids- en milieurisico’s. Goede veiligheidsmaatregelen en regelgeving zijn essentieel om het verantwoorde gebruik ervan in verschillende industrieën te garanderen.
Vragen:
Vraag: Welke van de volgende is een uitgebalanceerde vergelijking die de ontleding van lood(IV)oxide weergeeft?
A: De uitgebalanceerde vergelijking voor de ontleding van lood(IV)oxide is PbO2 → PbO + O2.
Vraag: Wat is de chemische formule voor lood(IV)oxide?
A: De chemische formule voor lood(IV)oxide is PbO2.
Vraag: Hoeveel gram lood(II)oxide wordt geproduceerd uit 86,5 gram kaliumjodide?
A: Om het aantal geproduceerde grammen lood(II)oxide te bepalen, hebben we een chemische reactievergelijking nodig waarbij kaliumjodide en PbO betrokken zijn.
Vraag: Wat is loodmonoxide?
A: Loodmonoxide verwijst naar elke verbinding die lood en zuurstof bevat en bestaat in verschillende vormen, waaronder lood(II)oxide (PbO) en lood(IV)oxide (PbO2).
Vraag: 0,632 mol lood werd geoxideerd tot lood(II)nitraat. Hoeveel mol zilver zou er worden afgezet?
A: Om het aantal mol zilver dat is afgezet te berekenen, hebben we een uitgebalanceerde chemische vergelijking nodig die de reductie van lood(II)nitraat tot zilver weergeeft.
Vraag: Wat is de naam van PbO?
A: De naam voor PbO is lood(II)oxide.
Vraag: Wat is het oxidatiegetal van lood?
A: Het oxidatiegetal van lood in PbO is +2, en in PbO2 is het +4.
Vraag: Is PbO amfoteer?
A: Nee, PbO is niet amfoteer; het vertoont geen zure of basische eigenschappen.
Vraag: Wat is PbO?
A: PbO is de chemische formule voor lood(II)oxide, een verbinding die in verschillende toepassingen wordt gebruikt, waaronder loodzuurbatterijen en glasproductie.
Vraag: Hoe kan de vergelijking Pb(NO3)2 = PbO + NO2 + O2 in evenwicht worden gebracht?
A: De uitgebalanceerde vergelijking voor de ontleding van lood(II)nitraat (Pb(NO3)2) is 2Pb(NO3)2 = 2PbO + 4NO2 + O2.
