Loodnitraat (Pb(NO₃)₂) is een witte kristallijne vaste stof. Het is oplosbaar in water en wordt in het laboratorium vaak gebruikt voor verschillende toepassingen, zoals de vervaardiging van andere loodverbindingen en vuurwerk.
| IUPAC-naam | Lood(II)nitraat |
| Moleculaire formule | Pb(NO₃)₂ |
| CAS-nummer | 10099-74-8 |
| Synoniemen | Loodnitraat, looddinitraat, lood(II)nitraat, lood(IV)nitraat |
| InChi | InChI=1S/2NO3.Pb/c2 2-1(3)4;/q2 -1;+2 |
Eigenschappen van loodnitraat
Loodnitraatformule
De chemische formule voor looddinitraat is Pb(NO₃)₂. Dit geeft aan dat elk looddinitraatmolecuul één loodatoom (Pb) bevat, gebonden aan twee NO₃-ionen. Deze formule is essentieel voor het begrijpen van de samenstelling en eigenschappen van de verbinding.
Loodnitraat molaire massa
De molaire massa van looddinitraat kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Voor lood (Pb) bedraagt de atoommassa ongeveer 207,2 g/mol en voor NO3 ongeveer 62,0 g/mol. De som van deze waarden levert voor looddinitraat een molaire massa op van ongeveer 331,2 g/mol.
Kookpunt van loodnitraat
Het kookpunt van looddinitraat is de temperatuur waarbij het onder normale atmosferische druk verandert van een vloeistof in een gas. Het kookpunt van looddinitraat is relatief hoog, rond de 470°C (878°F), waardoor het geschikt is voor bepaalde industriële toepassingen.
Smeltpunt van loodnitraat
Het smeltpunt van looddinitraat is de temperatuur waarbij het overgaat van vast naar vloeibaar. Looddinitraat heeft een smeltpunt van ongeveer 470°C (878°F). Deze eigenschap helpt bij het bepalen van de juiste opslag- en hanteringsomstandigheden.
Dichtheid van loodnitraat g/ml
De dichtheid van loodnitraat is een maat voor de massa per volume-eenheid. De dichtheid van looddinitraat is ongeveer 4,53 g/ml. Deze hoge dichtheid maakt het een zware stof en wordt in verschillende industriële en laboratoriumprocessen gebruikt.
Loodnitraat Molecuulgewicht
Het molecuulgewicht van looddinitraat, ook wel molmassa genoemd, bedraagt ongeveer 331,2 g/mol. Deze waarde is cruciaal bij stoichiometrische berekeningen en voor het bepalen van de hoeveelheid stof in een bepaald monster.
Structuur van loodnitraat
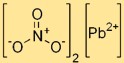
Looddinitraat heeft in vaste vorm een kristallijne structuur. Pb²⁺-kationen worden omgeven door NO₃⁻-anionen in een driedimensionale opstelling. Deze kristalroosterstructuur geeft loodnitraat zijn stabiliteit en karakteristieke eigenschappen.
Oplosbaarheid van loodnitraat
Loodnitraat is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een heldere, kleurloze oplossing. De oplosbaarheid van looddinitraat is essentieel bij verschillende toepassingen, zoals bij chemische reacties en als voorloper bij de synthese van andere loodverbindingen. Een juiste behandeling en verwijdering is van cruciaal belang vanwege de oplosbaarheid en de potentiële gevolgen voor het milieu.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 4,53 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 331,2 g/mol |
| Dikte | 4,53 g/ml |
| Fusie punt | 470°C (878°F) |
| Kookpunt | ~470°C (~878°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, enigszins oplosbaar in ethylalcohol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Neutraal (ongeveer 7) |
Veiligheid en gevaren van loodnitraat
Looddinitraat brengt verschillende veiligheidsrisico’s met zich mee. Direct contact met de verbinding kan huid en ogen irriteren. Het inademen van looddinitraatstof of dampen kan ademhalingsproblemen veroorzaken. Vanwege de oplosbaarheid in water kan het waterbronnen verontreinigen en het waterleven schaden. Bovendien zijn loodverbindingen giftig bij inname, en blootstelling aan lood kan leiden tot loodvergiftiging. Om de risico’s te minimaliseren, moeten passende veiligheidsmaatregelen worden genomen bij het hanteren van loodnitraat, zoals het gebruik van beschermende uitrusting, werken in een goed geventileerde ruimte en het volgen van vastgestelde richtlijnen voor opslag. behandeling en verwijdering. Het is essentieel om voorzichtig te zijn om schadelijke gevolgen voor de gezondheid en milieuverontreiniging te voorkomen.
| Gevarensymbolen | Gevaar voor de gezondheid, bijtend, irriterend |
| Beveiligingsbeschrijving | Irriterend. Vermijd direct contact. Gebruik PBM’s. |
| VN-identificatienummers | UN-nr. 1469 (Loodnitraat) |
| HS-code | 2834.29.1000 |
| Gevarenklasse | 5.1 (Oxidatiemiddel) |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen. |
Methoden voor de synthese van loodnitraat
Er zijn verschillende methoden voor het synthetiseren van looddinitraat, die allemaal de reactie van loodverbindingen met salpeterzuur omvatten.
Een gebruikelijke aanpak is het mengen van loodoxide (PbO) of loodcarbonaat (PbCO₃) met geconcentreerd salpeterzuur (HNO₃). Bij de reactie ontstaan looddinitraat en water. Een andere methode omvat het oplossen van metallisch lood of loodoxide in verdund salpeterzuur, wat leidt tot de vorming van looddinitraat.
De tweede methode betreft de reactie tussen Pb(OAc)₂ en natriumnitraat . Bij deze aanpak lost u Pb(OAc)₂ op in water en voegt u vervolgens natriumnitraat aan de oplossing toe. De reactie tussen deze twee verbindingen leidt tot de vorming van looddinitraat en natriumacetaat.
De chemicus moet metallisch lood of loodoxide oplossen in heet verdund salpeterzuur om looddinitraat in het laboratorium te synthetiseren. Ze moeten de reactie zorgvuldig controleren om te voorkomen dat er overmatige hitte en dampen ontstaan. Zodra de reactie voltooid is, wordt de looddinitraatoplossing gewoonlijk gezuiverd door filtratie of kristallisatie.
Het is van cruciaal belang om het syntheseproces zorgvuldig te beheren vanwege de toxiciteit van loodverbindingen. Om hun veiligheid te garanderen, moeten ze voor voldoende ventilatie zorgen en geschikte persoonlijke beschermingsmiddelen (PBM) dragen. Bovendien moeten ze al het afval op de juiste manier afvoeren om besmetting van het milieu te voorkomen.
Gebruik van loodnitraat
Looddinitraat vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Enkele van de belangrijkste toepassingen van looddinitraat zijn:
- Pyrotechnische producten: Fabrikanten gebruiken gewoonlijk looddinitraat om de helderheid en kleuren van pyrotechnische beeldschermen te verbeteren, omdat het als oxidatiemiddel werkt.
- Kleurstoffen- en pigmentindustrie: Bij de productie van sommige op lood gebaseerde pigmenten en kleurstoffen, zoals chroomgeel en oranje pigmenten, wordt looddinitraat als grondstof gebruikt.
- Thermische stabilisator: De kunststofindustrie gebruikt looddinitraat als thermische stabilisator voor PVC (polyvinylchloride) om thermische degradatie tijdens verwerking en gebruik te voorkomen.
- Lucifers: Luciferkoppen bevatten loodnitraat om ontstekingen te bevorderen wanneer ze tegen een ruw oppervlak worden geslagen.
- Galvaniseren: Galvaniseerbaden bevatten looddinitraat als een essentieel onderdeel om de afzetting van loodcoatings op verschillende oppervlakken te vergemakkelijken.
- Analytische chemie: Laboratoria gebruiken looddinitraat als reagens om specifieke chemische tests en analyses uit te voeren.
- Corrosieremmer: Sommige formuleringen gebruiken looddinitraat als corrosieremmer voor metalen en beschermen ze tegen oxidatie en afbraak.
- Farmaceutische producten: De farmaceutische industrie gebruikt af en toe looddinitraat als reagens in specifieke syntheseprocessen.
Vragen:
Vraag: Is loodnitraat oplosbaar?
A: Ja, loodnitraat is oplosbaar in water.
Vraag: Metallisch zilver wordt toegevoegd aan een oplossing van lood(ii)nitraat. Wat is een uitgebalanceerde chemische reactie?
A: Evenwichtige chemische reactie: 2Ag + Pb(NO₃)₂ → 2AgNO₃ + Pb.
Vraag: Is lood-ii-nitraat een elektrolyt?
A: Ja, lood(II)dinitraat is een elektrolyt.
Vraag: Wat is het massapercentage lood in lood(ii)nitraat (pb(no3)2), afgerond op drie significante cijfers?
A: Het massapercentage lood in Pb(NO₃)₂ bedraagt ongeveer 73,5%.
Vraag: Wat gebeurt er als loodnitraat wordt verwarmd?
A: Wanneer loodnitraat wordt verwarmd, valt het uiteen en ontstaan er loodoxide, stikstofdioxide en zuurstofgas.
Vraag: Is loodnitraat oplosbaar in water?
A: Ja, loodnitraat is zeer oplosbaar in water.
Vraag: Welke twee gassen komen vrij bij het verwarmen van loodnitraat?
A: De twee vrijkomende gassen zijn stikstofdioxide (NO₂) en zuurstof (O₂).
Vraag: Wat zie je als loodnitraat wordt verwarmd?
A: Wanneer looddinitraat wordt verwarmd, valt het uiteen, waarbij bruine stikstofdioxidedampen vrijkomen en er een geel residu van loodoxide achterblijft.
Vraag: Welk gas komt vrij als loodnitraat wordt verwarmd?
A: Bij het verwarmen van loodnitraat komt stikstofdioxidegas (NO₂) vrij.
Vraag: Wat zal er gebeuren als we een natriumjodide-oplossing en een lood(ii)-nitraatoplossing combineren?
A: Wanneer oplossingen van natriumjodide en lood(II)dinitraat worden gecombineerd, vormt zich een geel neerslag van loodjodide (PbI₂).
