Loodchloride (PbCl2) is een witte kristallijne vaste stof die wordt gevormd door lood en chloor te combineren. Het wordt gebruikt in verschillende toepassingen, waaronder pigmenten, kleurstoffen en als grondstof bij de chemische synthese.
| IUPAC-naam | Lood(II)chloride |
| Moleculaire formule | PbCl2 |
| CAS-nummer | 7758-95-4 |
| Synoniemen | Looddichloride, loodchloride, lood(II)dichloride, looddichloride |
| InChi | InChI=1S/2ClH.Pb/h2*1H;/q;;+2/p-2 |
Eigenschappen van loodchloride
Loodchloride-formule
De formule voor looddichloride is PbCl2. Dit geeft aan dat elke eenheid looddichloride één loodatoom (Pb) en twee chlooratomen (Cl) bevat. Deze witte kristallijne verbinding wordt gevormd door de combinatie van lood- en chlooratomen.
Molaire massa van loodchloride
De molaire massa van looddichloride is ongeveer 278,1 g/mol. Deze waarde wordt verkregen door de atoommassa’s van één loodatoom (207,2 g/mol) en twee chlooratomen (2 * 35,5 g/mol) op te tellen.
Kookpunt van loodchloride
Looddichloride heeft een kookpunt van ongeveer 1.074 graden Celsius (1.967 graden Fahrenheit). Bij deze temperatuur verandert vast looddichloride in de gasvormige toestand.
Smeltpunt van loodchloride
Het smeltpunt van looddichloride is ongeveer 501 graden Celsius (934 graden Fahrenheit). Bij deze temperatuur verandert vast looddichloride in een vloeibare toestand.
Dichtheid van loodchloride g/ml
Looddichloride heeft een dichtheid van ongeveer 5,85 g/ml. Deze dichtheidswaarde geeft de massa looddichloride aan die één milliliter volume in beslag neemt.
Loodchloride Molecuulgewicht
Het molecuulgewicht van looddichloride is ongeveer 278,1 g/mol. Het vertegenwoordigt de massa van één mol looddichloridemoleculen.
Structuur van loodchloride
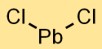
Looddichloride heeft een kristalstructuur waarin loodionen (Pb2+) in een roosteropstelling omgeven zijn door chloride-ionen (Cl-). Deze ionische binding draagt bij aan de stabiliteit en eigenschappen ervan.
Oplosbaarheid van loodchloride
Looddichloride heeft een beperkte oplosbaarheid in water. Het lost op in water en vormt een kleurloze oplossing. De oplosbaarheid ervan kan worden beïnvloed door factoren zoals temperatuur en de aanwezigheid van andere ionen. Looddichloride is echter beter oplosbaar in bepaalde zuren, zoals zoutzuur.
Samenvattend is looddichloride (PbCl2) een witte kristallijne verbinding met een molaire massa van ongeveer 278,1 g/mol. Het smeltpunt is ongeveer 501 graden Celsius en het kookpunt is ongeveer 1.074 graden Celsius. Met een dichtheid van 5,85 g/ml heeft looddichloride een beperkte oplosbaarheid in water en vormt het een duidelijke kristalstructuur vanwege de ionische binding tussen lood- en chloride-ionen.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 5,85 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 278,1 g/mol |
| Dikte | 5,85 g/ml |
| Fusie punt | 501°C |
| Kookpunt | 1074°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Begrenzing |
| Oplosbaarheid | Oplosbaar in sommige zuren, zoals zoutzuur |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Houd er rekening mee dat sommige eigenschappen, zoals vlampunt, dampdruk, dampdichtheid, pKa en pH, niet van toepassing zijn of niet direct beschikbaar zijn voor looddichloride.
Veiligheid en gevaren van loodchloride
Looddichloride brengt verschillende veiligheidsrisico’s met zich mee. Het is giftig als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen, waardoor gezondheidsrisico’s ontstaan, vooral voor kinderen en zwangere vrouwen. Bij het hanteren van looddichloride zijn geschikte beschermende uitrusting vereist, zoals handschoenen en een veiligheidsbril, om contact met de huid en ogen te voorkomen. Bovendien moet het in goed geventileerde ruimtes worden gebruikt om inademing van giftige dampen te voorkomen. Zorgvuldige opslag en hantering zijn essentieel om morsen en besmetting te voorkomen. In geval van accidentele blootstelling is onmiddellijke medische hulp noodzakelijk. Vanwege de toxiciteit ervan is het volgen van veiligheidsmaatregelen en het op de juiste wijze afvoeren van looddichloride essentieel om zowel de menselijke gezondheid als het milieu te beschermen.
| Gevarensymbolen | Gevaar, giftig |
| Beveiligingsbeschrijving | Giftig; Schadelijk bij inslikken, inademen of opname via de huid. Voorzichtig gebruiken. |
| VN-identificatienummers | N.v.t. (looddichloride krijgt geen UN-nummer) |
| HS-code | 2827399000 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III (Verpakkingsgroep III – Stoffen die een klein gevaar opleveren) |
| Toxiciteit | Zeer giftig; brengt gezondheidsrisico’s met zich mee, vooral voor kinderen en zwangere vrouwen. Gebruik passende veiligheidsmaatregelen. |
Let op: looddichloride heeft geen specifiek UN-nummer omdat het niet in grote hoeveelheden vervoerd wordt, maar valt wel onder de gevarenklasse van giftige stoffen (6.1). Vanwege de toxiciteit ervan moeten de juiste veiligheidsmaatregelen worden genomen bij het hanteren en gebruiken van looddichloride.
Methoden voor de synthese van loodchloride
Er bestaan verschillende methoden voor het synthetiseren van looddichloride. Een gebruikelijke aanpak is het verwarmen van metallisch lood en het doorlaten van chloorgas, wat resulteert in de vorming van looddichloride. Een andere methode omvat het laten reageren van loodoxide (PbO) met zoutzuur (HCl) om looddichloride en water te produceren.
Een andere route omvat de precipitatiemethode, waarbij oplosbare loodzouten reageren met oplosbare chloridezouten zoals natriumchloride (NaCl) , waarbij looddichloride ontstaat als een vast neerslag. Bij dubbele verdringingsreacties ontstaat looddichloride wanneer loodnitraat (Pb(NO3)2) reageert met een oplosbaar chloridezout zoals natriumchloride . Bij de reactie ontstaan looddichloride en natriumnitraat (NaNO3).
Om de veiligheid van de betrokkenen te garanderen en de impact op het milieu te minimaliseren, is het essentieel om tijdens het syntheseproces passende veiligheidsmaatregelen te volgen. Dit omvat het gebruik van voldoende ventilatie en het dragen van geschikte beschermende uitrusting vanwege de toxiciteit van looddichloride.
Gebruik van loodchloride
Looddichloride heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de toepassingen:
- Pigmenten: Looddichloride zorgt voor helderheid en dekking, waardoor het een wit pigment is dat wordt gebruikt in verven, coatings en kleurstoffen.
- Chemische synthese: Het speelt een cruciale rol als grondstof in chemische syntheseprocessen, vooral bij de productie van andere loodverbindingen en chemicaliën.
- PVC-stabilisator: Looddichloride verbetert de thermische stabiliteit en de algehele prestaties van polyvinylchloride (PVC) als stabilisator tijdens de productie.
- Laboratoriumreagens: Laboratoria gebruiken looddichloride als actief reagens voor specifieke chemische tests en analyses.
- Bijtmiddel bij het verven: Het functioneert actief als bijtmiddel bij verfprocessen, waardoor de hechting van kleurstoffen aan textiel en stoffen wordt vergemakkelijkt.
- Nucleaire toepassingen: Looddichloride beschermt effectief straling in reactoren en nucleaire faciliteiten vanwege de hoge dichtheid en het vermogen om gammastraling te absorberen.
- Galvaniseren: Bij galvanische toepassingen zet looddichloride actief een dunne laag lood af op verschillende metalen oppervlakken, waardoor de corrosieweerstand en geleidbaarheid worden verbeterd.
- Batterijen: Looddichloride speelt een cruciale rol in sommige soorten loodzuurbatterijen en draagt bij aan de batterijchemie.
Hoewel looddichloride verschillende toepassingen heeft, vereist de giftige aard ervan een zorgvuldige omgang en een juiste verwijdering om gevaren voor de gezondheid en het milieu te voorkomen.
Vragen:
Vraag: Hoeveel mol PbCl2 worden er gevormd?
A: Het aantal gevormde mol hangt af van de gegeven hoeveelheid reactanten en de uitgebalanceerde chemische vergelijking.
Vraag: Is PbCl2 oplosbaar in water?
A: PbCl2 heeft een beperkte oplosbaarheid in water.
Vraag: Hoeveel mol PbCl2?
A: Het aantal mol PbCl2 kan worden bepaald aan de hand van de massa en molaire massa.
Vraag: Welke van de volgende stoffen is onoplosbaar in water? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
A: PbCl2 is onoplosbaar in water.
Vraag: Is PbCl2 een neerslag?
A: Ja, als de Pb2+- en Cl-ionen in een reactie samenkomen om een vaste stof te vormen, is het een neerslag.
Vraag: Hoeveel mol loodchloride zal er worden gevormd?
A: Het aantal gevormde mol hangt af van de stoichiometrie van de reactie.
Vraag: Is loodchloride oplosbaar in water?
A: Looddichloride heeft een beperkte oplosbaarheid in water.
Vraag: Hoeveel formule-eenheden zitten er in 500,0 g lood(II)chloride?
A: Het aantal formule-eenheden kan worden berekend met behulp van de molaire massa en de constante van Avogadro.
Vraag: Hoe reageert lood(II)chloride in heet water?
A: Lood(II)dichloride kan gedeeltelijk oplossen in heet water vanwege de verhoogde oplosbaarheid bij temperatuur.
Vraag: Hoeveel gram zit er in 8,32 mol lood(II)chloride?
A: De massa kan worden bepaald met behulp van de molaire massa van lood(II)dichloride en het opgegeven aantal mol.
Vraag: Is loodchloride oplosbaar?
A: Looddichloride heeft een beperkte oplosbaarheid in water.
Vraag: Welke van de volgende zou deze reactie verschuiven naar vast loodchloride?
A: Het verwijderen van Cl-ionen uit het reactiemengsel zou het verschuiven naar de vorming van vast looddichloride.
Vraag: Wat is de formule voor lood(IV)dichloride?
A: De formule voor lood(IV)dichloride is PbCl4.
Vraag: De oplosbaarheid van lood(II)dichloride (PbCl2) is 1,6 × 10^-2 M. Wat is de Ksp van PbCl2?
A: De Ksp (oplosbaarheidsproductconstante) voor PbCl2 kan worden berekend op basis van de oplosbaarheid ervan.
