Loodacetaat (Pb(OAc)₂) is een witte kristallijne verbinding. Het wordt gebruikt in haarkleurmiddelen vanwege het vermogen om het haar donkerder te maken. Het brengt echter gezondheidsrisico’s met zich mee en moet met zorg worden behandeld.
| IUPAC-naam | Lood(II)acetaat |
| Moleculaire formule | Pb(OAc)₂ |
| CAS-nummer | 301-04-2 |
| Synoniemen | Lood(II)ethanolaat, loodacetaat, looddiacetaat |
| InChi | InChI=1S/2C2H4O2.Pb/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van loodacetaat
Loodacetaatformule
De chemische formule voor looddiacetaat is Pb(OAc)₂, waarbij Pb het symbool voor lood is en OAc het ion CH₃COO⁻. Het is een witte kristallijne verbinding met twee CH₃COO⁻-ionen per loodatoom.
Molaire massa van loodacetaat
Looddiacetaat heeft een molaire massa van ongeveer 325,29 g/mol. Om dit te berekenen, tellen we de atoommassa van een Pb-atoom en twee CH₃COO⁻-ionen op die aanwezig zijn in de chemische formule.
Kookpunt van loodacetaat
Het kookpunt van looddiacetaat is ongeveer 280°C (536°F). Bij blootstelling aan hoge temperaturen ondergaat het een faseovergang van vast naar vloeibaar, waardoor het van cruciaal belang is om er voorzichtig mee om te gaan.
Loodacetaat Smeltpunt
Looddiacetaat heeft een smeltpunt van ongeveer 280°C (536°F). Bij deze temperatuur verandert de vaste verbinding in een vloeistof, waardoor deze geschikt is voor bepaalde toepassingen, zoals haarkleuringen.
Dichtheid van loodacetaat g/ml
De dichtheid van looddiacetaat is ongeveer 3,25 g/ml. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid en is belangrijk voor het begrijpen van de fysieke eigenschappen en toepassingen ervan.
Loodacetaat Molecuulgewicht
Het molecuulgewicht van looddiacetaat is ongeveer 325,29 g/mol. Het biedt essentiële informatie voor verschillende chemische berekeningen en helpt onderzoekers het gedrag en de reactiviteit ervan te begrijpen.
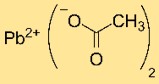
Loodacetaatstructuur
Looddiacetaat heeft een kristalstructuur met Pb²⁺-kationen gecoördineerd met twee CH₃COO⁻-ionen. De rangschikking van atomen en bindingen in het kristalrooster bepaalt de stabiliteit en eigenschappen ervan.
Oplosbaarheid van loodacetaat
Looddiacetaat is slecht oplosbaar in water. Het lost tot op zekere hoogte op en vormt een heldere, kleurloze oplossing. De oplosbaarheid varieert met de temperatuur, waardoor de opslag en de juiste hantering ervan cruciaal zijn om milieuverontreiniging te voorkomen.
| Verschijning | Wit kristallijn |
| Soortelijk gewicht | ~3,25 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | ~325,29 g/mol |
| Dikte | ~3,25 g/ml |
| Fusie punt | ~280°C (536°F) |
| Kookpunt | ~280°C (536°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Beperkte oplosbaarheid, varieert met de temperatuur |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van loodacetaat
Looddiacetaat brengt aanzienlijke veiligheidsrisico’s met zich mee en moet met grote voorzichtigheid worden behandeld. Het is giftig als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Langdurige blootstelling kan leiden tot loodvergiftiging, met nadelige gevolgen voor de gezondheid, waaronder het zenuwstelsel en de nieren. Vermijd contact met ogen, huid en kleding. Gebruik bij het hanteren voldoende ventilatie en persoonlijke beschermingsmiddelen. Voorkom dat het in het milieu terechtkomt, omdat het de bodem en het water kan verontreinigen en ecosystemen kan aantasten. Houd het buiten bereik van kinderen en dieren. Gooi het op de juiste manier weg volgens de plaatselijke regelgeving. Over het algemeen is strikte naleving van veiligheidsrichtlijnen cruciaal om risico’s te minimaliseren.
| Gevarensymbolen | Gezondheidsrisico, milieurisico |
| Beveiligingsbeschrijving | Giftig en schadelijk voor het milieu |
| VN-identificatienummers | VN1616 |
| HS-code | 29152900 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van loodacetaat
Er zijn verschillende methoden voor het synthetiseren van looddiacetaat.
Een gebruikelijke aanpak is om metallisch lood te laten reageren met azijnzuur . Bij deze methode voegt u doorgaans lood toe aan een container en giet u langzaam azijnzuur in de container, terwijl u de omstandigheden zoals roeren en temperatuurregeling controleert. De reactie verloopt en vormt looddiacetaat als een wit neerslag.
Een andere methode is de reactie van loodoxide (PbO) of loodcarbonaat (PbCO₃) met ijsazijn. Je mengt loodoxide of loodcarbonaat met azijnzuur en verwarmt het mengsel, waardoor een reactie ontstaat die resulteert in looddiacetaat.
Een andere syntheseroute bestaat uit het uitvoeren van de dubbele verdringingsreactie van Pb(NO₃)₂ met CH3COONa in een waterige oplossing. Bij deze reactie ontstaat looddiacetaat als neerslag.
Het is essentieel om deze synthetische methoden met voorzichtigheid te hanteren vanwege de toxiciteit van loodverbindingen. U moet passende veiligheidsmaatregelen volgen en processen uitvoeren in goed geventileerde ruimtes met de juiste beschermende uitrusting. Bovendien is het volgen van de regelgeving inzake afvalverwerking van cruciaal belang om milieuverontreiniging te voorkomen.
Gebruik van loodacetaat
Looddiacetaat vindt vanwege zijn unieke eigenschappen diverse toepassingen. Hier zijn enkele toepassingen:
- Haarverf : Sommige haarkleurmiddelen gebruiken looddiacetaat om het haar na verloop van tijd geleidelijk donkerder te maken. Vanwege de toxiciteit ervan is het gebruik ervan in cosmetische producten in veel landen echter beperkt.
- Laboratoriumreagens : Het wordt gebruikt als reagens in laboratoria voor verschillende chemische reacties en analyses.
- Fotografie: In het verleden gebruikten fotografen looddiacetaat om fotografische films en papier gevoeliger te maken bij het fotograferen van zwart-wit.
- Suiker van lood: Historisch gezien gebruikten mensen diacetaat van lood, bekend als ‘loodsuiker’, om wijn en andere dranken te conserveren.
- Analytische chemie: In de analytische chemie gebruiken wetenschappers looddiacetaat om de aanwezigheid van waterstofsulfidegas te detecteren.
- Bijtmiddel bij het verven : Het werkt als bijtmiddel bij het verven en bedrukken van textiel.
- Chemische synthese : Het dient als voorloper voor de synthese van andere hoofdverbindingen.
Ondanks de verschillende toepassingen is het essentieel om voorzichtig te zijn met looddiacetaat vanwege de hoge toxiciteit ervan. Minimaliseer de blootstelling aan loodverbindingen en volg strikt de juiste veiligheidsmaatregelen bij het hanteren en weggooien ervan om de menselijke gezondheid en het milieu te beschermen. Beperk of vervang veel van zijn apps door veiligere alternatieven.
Vragen:
Vraag: Is lood II-acetaat oplosbaar in water?
A: Lood II-diacetaat is slecht oplosbaar in water.
Vraag: Is loodacetaat oplosbaar?
A: Looddiacetaat is slecht oplosbaar in water.
Vraag: Welke haarkleurmiddelen bevatten loodacetaat?
A: In sommige landen bevatten sommige progressieve haarkleurmiddelen looddiacetaat als ingrediënt, hoewel het gebruik ervan beperkt is vanwege zorgen over toxiciteit.
Vraag: Welke problemen kan chronische blootstelling aan azijnzuur veroorzaken?
A: Chronische blootstelling aan azijnzuur kan irritatie van de luchtwegen en de huid veroorzaken.
Vraag: Wat is de formule voor lood II-diacetaat?
A: De formule voor lood II-diacetaat is Pb(OAc)₂.
Vraag: Welk loodacetaat wordt gebruikt in de Lindlar-katalysator?
A: Lood(II)diacetaat wordt over het algemeen niet gebruikt in de Lindlar-katalysator; in plaats daarvan wordt palladiumacetaat gebruikt.
Vraag: Wat is loodacetaat?
A: Looddiacetaat is een witte kristallijne verbinding die in verschillende toepassingen wordt gebruikt, zoals haarkleurmiddelen en chemische synthese.
Vraag: Hoe maak je loodacetaat?
A: Looddiacetaat kan worden bereid door metallisch lood te laten reageren met azijnzuur of door andere chemische synthesemethoden.
Vraag: Zijn er haarkleurmiddelen zonder loodacetaat?
A: Ja, veel moderne haarkleurmiddelen bevatten geen looddiacetaat, omdat het gebruik ervan in cosmetische producten in veel landen aan beperkingen is onderworpen vanwege de toxiciteit ervan.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van aluminiumjodide en lood(II)acetaat worden gecombineerd?
A: Ja, er vindt een reactie plaats en PbI2 en aluminiumacetaat worden als producten gevormd.
Vraag: Reageren natriumchromaat en lood(II)acetaat?
A: Ja, er vindt een reactie plaats die resulteert in de vorming van PbCrO4 en natriumacetaat.
Vraag: Welke chemische stof reageert met koper(II)sulfaat om blauw te produceren en met lood(II)acetaat om wit te produceren?
A: Ammoniumhydroxide reageert met koper(II)sulfaat en vormt blauwe neerslagen (koperhydroxide). Daarentegen reageert waterstofsulfide met lood (II) diacetaat om wit loodsulfide te creëren.
