Lithiumbicarbonaat (LiHCO3) is een chemische verbinding die in verschillende toepassingen wordt gebruikt. Het heeft alkalische eigenschappen en wordt gebruikt in onderzoek, in farmaceutische producten en als mogelijke behandeling voor bepaalde medische aandoeningen.
| IUPAC-naam | Lithiumbicarbonaat |
| Moleculaire formule | LiHCO3 |
| CAS-nummer | 5006-97-3 |
| Synoniemen | Lithiumwaterstofcarbonaat, Li-bicarbonaat |
| InChi | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Eigenschappen van lithiumbicarbonaat
Lithiumbicarbonaatformule
Lithiumwaterstofcarbonaat heeft de chemische formule LiHCO3. Het bestaat uit een lithiumkation (Li), een waterstofcarbonaatanion (HCO3) en een waterstofatoom (H). De formule weerspiegelt de aanwezigheid van lithium- en bicarbonaationen in de verbinding.
Molaire massa van lithiumbicarbonaat
De molaire massa van lithiumwaterstofcarbonaat (LiHCO3) is ongeveer 68 gram per mol (g/mol). Het wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen: lithium, waterstof, koolstof en zuurstof.
Kookpunt van lithiumbicarbonaat
Lithiumwaterstofcarbonaat heeft geen goed gedefinieerd kookpunt omdat het bij hoge temperaturen ontleedt. Naarmate het warmer wordt, verliest het kooldioxide (CO2) en water (H2O) en wordt het omgezet in lithiumcarbonaat (Li2CO3).
Lithiumbicarbonaat Smeltpunt
Lithiumwaterstofcarbonaat heeft een smeltpunt van ongeveer 250 graden Celsius (482 graden Fahrenheit). Bij deze temperatuur ondergaat het een faseovergang van vaste naar vloeibare toestand.
Dichtheid van lithiumbicarbonaat g/ml
De dichtheid van lithiumwaterstofcarbonaat (LiHCO3) is ongeveer 2,21 gram per milliliter (g/ml). Het is een relatief dichte verbinding vanwege de aanwezigheid van lithium en andere zware elementen.
Lithiumbicarbonaat Molecuulgewicht
Lithiumwaterstofcarbonaat heeft een molecuulgewicht van ongeveer 68 g/mol. Het molecuulgewicht vertegenwoordigt de som van de atoomgewichten van alle atomen in een enkel molecuul van de verbinding.
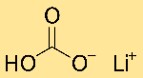
Structuur van lithiumbicarbonaat
Lithiumwaterstofcarbonaat heeft een kristallijne structuur. Het vormt een netwerk van lithium-, waterstofcarbonaat- en waterstofatomen, gerangschikt in een zich herhalend patroon. De structuur wordt bij elkaar gehouden door ionische en covalente bindingen.
Oplosbaarheid van lithiumbicarbonaat
Lithiumwaterstofcarbonaat is slecht oplosbaar in water. Het lost enigszins op in water, waardoor een licht alkalische oplossing ontstaat. De oplosbaarheid ervan is echter relatief laag in vergelijking met andere lithiumverbindingen.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | ~2,21 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | ~68 g/mol |
| Dikte | ~2,21 g/ml |
| Fusie punt | ~250°C (482°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar, waardoor een licht alkalische oplossing ontstaat |
| Oplosbaarheid | Begrenzing |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Licht alkalisch |
Veiligheid en gevaren van lithiumbicarbonaat
Lithiumwaterstofcarbonaat kent bepaalde veiligheidsoverwegingen en gevaren. Het is essentieel om zorgvuldig met het mengsel om te gaan om de risico’s te minimaliseren. Direct contact met huid of ogen kan irritatie veroorzaken. Het inademen van stof of dampen moet worden vermeden, omdat dit ademhalingsproblemen kan veroorzaken. Bij verhitting valt het uiteen, waarbij kooldioxide en waterdamp vrijkomen, wat potentieel gevaarlijk kan zijn in besloten ruimtes. Bovendien is het van cruciaal belang om lithiumwaterstofcarbonaat op de juiste manier op te slaan, uit de buurt van onverenigbare stoffen. Bij het werken met dit middel moeten adequate ventilatie en persoonlijke beschermingsmiddelen worden gebruikt om een veilige omgeving te garanderen.
| Gevarensymbolen | Niet beschikbaar |
| Beveiligingsbeschrijving | Breekbaar. Vermijd inademing, contact met huid en ogen. Op de juiste manier bewaren. Gebruik in goed geventileerde ruimtes. |
| VN-identificatienummers | Niet beschikbaar |
| HS-code | Niet beschikbaar |
| Gevarenklasse | Niet beschikbaar |
| Verpakkingsgroep | Niet beschikbaar |
| Toxiciteit | Lage toxiciteit; afhandelen met borg. |
Methoden voor het synthetiseren van lithiumbicarbonaat
Verschillende methoden maken de synthese van lithiumwaterstofcarbonaat mogelijk.
Een gebruikelijke aanpak is om lithiumhydroxide (LiOH) te laten reageren met koolstofdioxide (CO2). De reactie vindt plaats in een waterige oplossing waarbij lithiumhydroxide dissocieert in lithium- en hydroxide-ionen. Tegelijkertijd lost kooldioxide op in water en vormt koolzuur (H2CO3) . De lithiumionen reageren vervolgens met koolzuur en produceren lithiumwaterstofcarbonaat (LiHCO3) en water (H2O). De chemische vergelijking voor deze reactie is:
LiOH + CO2 → LiHCO3 + H2O
Een andere methode is het behandelen van lithiumcarbonaat (Li2CO3) met koolstofdioxide in een gesloten systeem, waarbij lithiumbicarbonaat wordt geproduceerd. De chemische vergelijking voor deze reactie is:
Li2CO3 + CO2 → 2LiHCO3
Deze synthesemethoden zijn belangrijk voor de productie van lithiumwaterstofcarbonaat in het laboratorium en voor industriële toepassingen. Het is van cruciaal belang om veiligheidsprotocollen te volgen en te zorgen voor de juiste apparatuur en omstandigheden tijdens het syntheseproces.
Gebruik van lithiumbicarbonaat
Lithiumwaterstofcarbonaat vindt vele toepassingen vanwege zijn unieke eigenschappen. Hier zijn enkele van de belangrijkste toepassingen:
- Onderzoek en laboratorium: Het dient als een waardevol reagens in verschillende chemische en onderzoeksexperimenten, waardoor wetenschappers chemische reacties en eigenschappen kunnen bestuderen.
- Potentiële medische behandeling: Er worden onderzoeken gedaan naar de potentiële rol ervan als behandeling voor ziekten zoals lithiumtekort en bepaalde nieraandoeningen, evenals als alkaliserend middel.
- Milieutoepassingen: Het kan bijdragen aan de verwijdering van kooldioxide uit industriële processen en heeft potentiële toepassingen bij het verminderen van de uitstoot van broeikasgassen.
- Alkaliserend middel: In specifieke industriële processen fungeert het als een alkaliserend middel om de zuurgraad onder controle te houden en de pH-waarde te reguleren.
- Farmaceutische industrie: Farmaceutische formuleringen gebruiken lithiumwaterstofcarbonaat voornamelijk in medicijnen voor stemmingsstoornissen zoals een bipolaire stoornis.
- Productie van lithiumbatterijen: Onderzoekers en experimentele kringen onderzoeken het gebruik van lithiumwaterstofcarbonaat in geavanceerde op lithium gebaseerde batterijen om de batterijprestaties te verbeteren.
- Waterbehandeling: Waterbehandelingsprocessen gebruiken lithiumbicarbonaat om de pH van waterbronnen aan te passen.
- Landbouw: Lithiumwaterstofcarbonaat wordt beperkt gebruikt in landbouwpraktijken, waar boeren het gebruiken om specifieke bodemomstandigheden te behandelen en de plantengroei te verbeteren.
Ondanks deze toepassingen is het van cruciaal belang om voorzichtig om te gaan met lithiumwaterstofcarbonaat en de veiligheidsmaatregelen te volgen, gezien de potentiële gevaren en reactiviteit ervan. Naarmate onderzoek en technologische vooruitgang voortduren, kunnen er nieuwe toepassingen voor lithiumwaterstofcarbonaat ontstaan, waardoor het belang ervan op verschillende gebieden verder wordt vergroot.
Vragen:
Vraag: Wat is de chemische formule van lithiumbicarbonaat?
A: De chemische formule van lithiumwaterstofcarbonaat is LiHCO3.
Vraag: Kan lithiumbicarbonaat een laag vitamine D-gehalte veroorzaken?
A: Er zijn geen aanwijzingen dat lithiumwaterstofcarbonaat lage vitamine D-spiegels veroorzaakt.
Vraag: Wat werkt beter: lithiumcarbonaat of lithiumbicarbonaat?
A: De effectiviteit van lithiumcarbonaat of lithiumbicarbonaat hangt af van hun specifieke toepassingen en het beoogde gebruik.
Vraag: Heeft lithiumbicarbonaat een wisselwerking met valeriaanextract?
A: Er zijn geen interacties bekend tussen lithiumwaterstofcarbonaat en valeriaanextract, maar overleg met een beroepsbeoefenaar in de gezondheidszorg is essentieel.
Vraag: Wat is lithiumbicarbonaat?
A: Lithiumwaterstofcarbonaat is een chemische verbinding met alkalische eigenschappen, die wordt gebruikt in een verscheidenheid aan toepassingen, waaronder onderzoek en farmaceutische producten.
Vraag: Kunnen lithiumbicarbonaat en lithiumcarbonaat in water worden verwarmd?
A: Lithiumwaterstofcarbonaat en lithiumcarbonaat kunnen in water worden verwarmd, maar ze zullen uiteenvallen en andere verbindingen vormen.
Vraag: Wat is het gewichtsverlies als 3,45 g LiHCO3 wordt afgebroken?
A: Het gewichtsverlies wanneer 3,45 g LiHCO3 wordt afgebroken, hangt af van de specifieke reactie en de gevormde producten.
Vraag: Is LiHCO3 een sterke elektrolyt?
A: Nee, lithiumwaterstofcarbonaat (LiHCO3) is een zwakke elektrolyt.
Vraag: Welk zout zou worden geproduceerd door de reactie van H2SO4 met LiHCO3?
A: De reactie tussen H2SO4 en LiHCO3 produceert lithiumsulfaat (Li2SO4), kooldioxide (CO2) en water (H2O).
Vraag: Is LiHCO3 een zuur of een base?
A: Lithiumwaterstofcarbonaat (LiHCO3) fungeert als base vanwege zijn alkalische eigenschappen.
Vraag: Reageert N-methylethanamine met LiHCO3?
A: De reactiviteit van N-methylethanamine met LiHCO3 zal afhangen van de specifieke reactieomstandigheden en gewenste producten.
