Kwikchloride is een giftige verbinding met de formule HgCl2. Het is een witte kristallijne vaste stof die in laboratoria wordt gebruikt als reagens en desinfectiemiddel, maar een juiste omgang is essentieel.
| IUPAC-naam | Kwik(II)chloride |
| Moleculaire formule | HgCl2 |
| CAS-nummer | 7487-94-7 |
| Synoniemen | Kwikdichloride, kwikdichloride, kwikbichloride, kwik(II)dichloride |
| InChi | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Eigenschappen van kwikchloride
Kwikchloride-formule
De formule voor kwikdichloride is HgCl2. Het bestaat uit één kwikatoom (Hg) en twee chlooratomen (Cl). Deze verbinding is ook bekend als kwik(II)chloride en symboliseert de +2 oxidatietoestand van kwik.
Kwikchloride molaire massa
De molaire massa van kwikdichloride is ongeveer 271,52 g/mol. Het wordt berekend door de atoommassa’s van één kwikatoom (200,59 g/mol) en twee chlooratomen (elk 35,45 g/mol) bij elkaar op te tellen.
Kookpunt van kwikchloride
Kwikdichloride heeft een kookpunt van ongeveer 302°C (575,6°F). Bij deze temperatuur verandert vast kwikdichloride in damp.
Smeltpunt van kwikchloride
Het smeltpunt van kwikdichloride is ongeveer -71°C (-95,8°F). Bij deze temperatuur verandert vast kwikdichloride in vloeistof.
Dichtheid van kwikchloride g/ml
De dichtheid van kwikdichloride is ongeveer 5,4 g/ml. Door deze hoge dichtheid is het een relatief zware stof.
Kwikchloride Molecuulgewicht
Het molecuulgewicht van kwikdichloride is ongeveer 271,52 g/mol. Het geeft de massa van één mol van de verbinding aan en komt overeen met de som van de atoomgewichten.
Structuur van kwikchloride
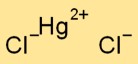
Kwikdichloride heeft een kristallijne structuur. Het bestaat uit positief geladen kwikionen (Hg2+) en negatief geladen chloride-ionen (Cl-), bij elkaar gehouden door ionische bindingen. De opstelling vormt een roosterachtig patroon.
Oplosbaarheid van kwikchloride
Kwikdichloride heeft een beperkte oplosbaarheid in water. Ongeveer 7,7 gram kwikdichloride kan oplossen in 100 ml water bij kamertemperatuur (20°C). De oplosbaarheid ervan neemt toe bij hogere temperaturen.
Kwikdichloride is een zeer giftige stof en moet met uiterste voorzichtigheid worden gehanteerd. Het is op grote schaal gebruikt in verschillende toepassingen, onder meer als reagens in chemische laboratoria, als desinfectiemiddel en bij galvaniseerprocessen. Vanwege de toxiciteit is het essentieel om de juiste veiligheidsprotocollen te volgen bij het werken met deze verbinding.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 5,4 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 271,52 g/mol |
| Dikte | 5,4 g/ml |
| Fusie punt | -71°C (-95,8°F) |
| Kookpunt | 302°C (575,6°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Begrenzing |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals alcohol, ether |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | 8,23 (lucht = 1) |
| pKa | Niet toepasbaar |
| pH | Zuur (in water) |
Veiligheid en gevaren van kwikchloride
Kwikdichloride brengt aanzienlijke veiligheidsrisico’s met zich mee vanwege de extreme toxiciteit ervan. Direct contact met de huid of het inademen van de dampen kan ernstige gezondheidsproblemen veroorzaken. Het is essentieel om er met de grootste zorg mee om te gaan, en gebruik te maken van de juiste beschermende uitrusting, zoals handschoenen en een gasmasker. Werk altijd in een goed geventileerde ruimte om blootstelling te minimaliseren. Bewaar het in goed gesloten containers, uit de buurt van onverenigbare stoffen. In geval van inslikken of accidentele blootstelling, dient u onmiddellijk medische hulp in te roepen. Om besmetting van het milieu te voorkomen, moeten de juiste verwijderingsmethoden worden gevolgd. Over het algemeen is strikte naleving van veiligheidsprotocollen van cruciaal belang bij de omgang met kwikdichloride.
| Gevarensymbolen | Schedel en gekruiste knekels, bijtend |
| Beveiligingsbeschrijving | Zeer giftig en bijtend. Gebruik met uiterste voorzichtigheid. Vermijd direct contact en inademing van dampen. |
| VN-identificatienummers | UN1624 (Kwikverbindingen, nrs.) |
| HS-code | 2852.10.10 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II (gemiddeld) |
| Toxiciteit | Zeer giftig voor mens en dier. Ga er voorzichtig mee om en volg strikte veiligheidsprotocollen. |
Methoden voor de synthese van kwikchloride
Er zijn verschillende methoden voor het synthetiseren van kwikdichloride.
Een gebruikelijke aanpak omvat de reactie van metallisch kwik met zoutzuur . Voeg in een gecontroleerde omgeving kwik toe aan het zuur om kwikdichloride te produceren en waterstofgas vrij te maken. De chemische vergelijking voor deze reactie is:
Hg + 2HCl -> HgCl2 + H2
Een andere methode maakt gebruik van de reactie tussen kwikoxide (HgO) en zoutzuur . Combineer kwikoxide met zuur om kwikdichloride en water te vormen:
HgO + 2HCl -> HgCl2 + H2O
Bovendien kan kwikdichloride worden geproduceerd door kwik te laten reageren met chloorgas:
Hg + Cl2 -> HgCl2
Vergeet niet om de synthese van kwikdichloride alleen uit te voeren onder een goed geventileerde kap of onder gecontroleerde omstandigheden vanwege de giftige en corrosieve aard ervan. Zorgvuldige hantering en het volgen van veiligheidsmaatregelen zijn essentieel om schadelijke blootstelling tijdens het syntheseproces te voorkomen.
Gebruik van kwikchloride
Kwikdichloride, ook bekend als kwik(II)chloride, heeft vanwege zijn unieke eigenschappen verschillende toepassingen op verschillende gebieden gevonden. Hier zijn enkele van de belangrijkste toepassingen:
Laboratoriumreagens: Kwikdichloride dient als een belangrijk reagens in chemische laboratoria voor verschillende analytische en synthetische procedures.
Desinfectiemiddel: De sterke antimicrobiële eigenschappen maken het waardevol als desinfectiemiddel, vooral voor het steriliseren van apparatuur en oppervlakken.
Geneeskunde: Hoewel beperkt vanwege de toxiciteit, wordt het in de traditionele geneeskunde voor bepaalde aandoeningen gebruikt.
Fotografie: In het verleden speelde kwikchloride een rol in de vroege fotografie als fixeermiddel voor het ontwikkelen van foto’s.
Galvaniseren: Bij galvaniseerprocessen gebruiken individuen kwikdichloride als elektrolyt om metaalcoatings op verschillende voorwerpen af te zetten.
Houtbehoud: Door de geschiedenis heen hebben mensen het gebruikt om hout te behandelen en het te beschermen tegen rot en ongedierte.
Textielindustrie: Fabrikanten gebruikten kwikchloride om kleur uit textiel te verwijderen tijdens verfprocessen.
Analytische chemie: Chemici gebruiken het voor specifieke tests en reacties bij chemische analyse.
Niche organische synthese: het vindt toepassingen in specifieke organische synthesereacties.
Fungicide en algicide: Boeren gebruiken het actief als fungicide en algicide om de groei van schimmels en algen in de landbouw onder controle te houden.
Vragen:
Vraag: Is HgCl2 oplosbaar of onoplosbaar in water?
A: HgCl2 is enigszins oplosbaar in water.
Vraag: Wat zijn het kation en anion van de verbinding HgCl2?
A: Het kation is Hg2+ (kwik) en het anion is Cl- (chloride).
Vraag: Is HgCl2 ionisch of covalent?
A: HgCl2 is een ionische verbinding.
Vraag: Hoe maak je kwikchloride in Minecraft?
A: In Minecraft kan kwikdichloride worden gesynthetiseerd door kwik en chloor te combineren op een werktafel.
Vraag: Waar wordt kwikchloride voor gebruikt?
A: Kwikdichloride wordt in laboratoria gebruikt als reagens en desinfectiemiddel.
Vraag: Wie heeft kwikchloride uitgevonden?
A: De ontdekking en het eerste gebruik van kwikdichloride dateren uit de oudheid, er bestaat dus geen specifieke inventaris.
Vraag: Hoe maak je kwikchloride in Minecraft Education Edition?
A: In Minecraft Education Edition kan kwikdichloride worden gemaakt door kwik en chloor te combineren op een werktafel, net als in de standaard Minecraft-versie.
Vraag: Wat is kwikchloride?
A: Kwikdichloride is een giftige verbinding met de chemische formule HgCl2.
Vraag: Is HgCl2 een vaste stof?
A: Ja, HgCl2 is een vaste stof bij kamertemperatuur.
Vraag: Wat is de juiste naam voor HgCl2 bij ionische naamgeving?
A: De juiste naam voor HgCl2 in de ionische naamgeving is kwik(II)dichloride.
Vraag: Wat is de naam van HgCl2?
A: De naam van HgCl2 is kwikdichloride.
Vraag: 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), wat is de snelheidswet van de reactie?
A: Tariefwet: Tarief = k[HgCl2]^2[C2O4^2-] (tweede orde met betrekking tot HgCl2 en eerste orde met betrekking tot C2O4^2-).
