Kopernitraat (Cu(NO3)2) is een blauwkristallijne verbinding die in verschillende industrieën wordt gebruikt. Het dient als katalysator, oxidatiemiddel en voorloper van kopermaterialen in chemische processen.
| IUPAC-naam | Koper(II)nitraat |
| Moleculaire formule | Cu(NO3)2 |
| CAS-nummer | 3251-23-8 |
| Synoniemen | Kopernitraat; Kopernitraat; Kopernitraat; Salpeterzuur, koperzout (2+) |
| InChi | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Eigenschappen van kopernitraat
Kopernitraatformule
De chemische formule voor kopernitraat is Cu(NO3)2. Dit geeft aan dat elk kopernitraatmolecuul één koperion (Cu) en twee nitraationen (NO3) bevat. De aanwezigheid van koper(II)-ionen duidt op een +2 oxidatietoestand van koper.
Kopernitraat molaire massa
De molaire massa van kopernitraat kan worden berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. Koper (Cu) heeft een molaire massa van ongeveer 63,55 g/mol, terwijl nitraat (NO3) een molaire massa heeft van ongeveer 62,00 g/mol. De molaire massa van kopernitraat is dus ongeveer 187,55 g/mol.
Kookpunt van kopernitraat
Het kookpunt van kopernitraat verwijst naar de temperatuur waarbij het onder standaard atmosferische druk verandert van een vloeistof in een gas. Het kookpunt van kopernitraat ligt doorgaans boven de 100 °C (212 °F). Het is echter belangrijk op te merken dat kopernitraat in het algemeen ontleedt voordat het zijn kookpunt bereikt.
Smeltpunt van kopernitraat
Het smeltpunt van kopernitraat is de temperatuur waarbij het overgaat van een vaste naar een vloeibare toestand. Het smeltpunt van kopernitraat ligt doorgaans tussen 256°C en 260°C (493°F en 500°F). Het is essentieel om voorzichtig met deze stof om te gaan om ontleding te voorkomen.
Dichtheid van kopernitraat g/ml
De dichtheid van kopernitraat verwijst naar de massa per volume-eenheid. De dichtheid van vast kopernitraat ligt doorgaans rond de 2,32 g/ml, terwijl de dichtheid van de waterige oplossingen kan variëren afhankelijk van de concentratie.
Kopernitraat Moleculair gewicht
Het molecuulgewicht van kopernitraat is de som van de atoomgewichten van alle atomen in de chemische formule. Voor Cu(NO3)2 bedraagt het molecuulgewicht ongeveer 187,55 g/mol.
Structuur van kopernitraat
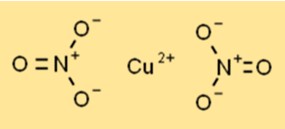
Kopernitraat bestaat als een blauwe kristallijne vaste stof met een hexagonale kristalstructuur. Elk koperion (Cu2+) is omgeven door zes zuurstofatomen uit twee nitraationen, waardoor een gecoördineerde opstelling ontstaat. De structuur draagt bij aan de stabiliteit en reactiviteit ervan in verschillende chemische processen.
Oplosbaarheid van kopernitraat
Kopernitraat is matig oplosbaar in water. Het vormt een waterige oplossing wanneer het wordt opgelost in water, die kan worden gebruikt in verschillende toepassingen, zoals galvaniseren en als reagens bij chemische reacties. De oplosbaarheid neemt echter af bij lagere temperaturen.
| Verschijning | Blauwe kristallijne vaste stof |
| Soortelijk gewicht | N.v.t |
| Kleur | Blauw |
| Geur | Geurloos |
| Molaire massa | 187,55 g/mol |
| Dikte | 2,32 g/ml (vast) |
| Fusie punt | 256-260°C (493-500°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Matig oplosbaar, vormt een waterige oplossing |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | Zuur |
Veiligheid en gevaren van kopernitraat
Kopernitraat brengt bepaalde veiligheids- en gevarenproblemen met zich mee. Het is essentieel om voorzichtig met dit middel om te gaan. Direct contact met de huid of ogen kan irritatie of brandwonden veroorzaken. Inademing van stof of dampen kan irritatie van de luchtwegen veroorzaken. Bij verhitting kunnen giftige stikstofoxiden vrijkomen. De stof is ook een oxidatiemiddel en kan bij contact brandbare materialen doen ontbranden. Bij het werken met kopernitraat moeten de juiste beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gedragen. Het moet uit de buurt van brandbare materialen en onverenigbare stoffen worden bewaard om potentiële risico’s te minimaliseren. Volg altijd de veiligheidsinstructies en gebruik het in een goed geventileerde ruimte.
| Gevarensymbolen | Oxidatiemiddel, Bijtend, Irriterend |
| Beveiligingsbeschrijving | Afhandelen met borg. Vermijd contact met huid en ogen. Gebruik in een goed geventileerde ruimte. Verwijderd houden van brandbare materialen. |
| VN-identificatienummers | UN3085 |
| HS-code | 28342910 |
| Gevarenklasse | 5.1 (Oxidatiemiddel) |
| Verpakkingsgroep | III |
| Toxiciteit | Schadelijk bij inslikking. Kan huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van kopernitraat
Er zijn verschillende methoden voor het synthetiseren van kopernitraat.
Een gebruikelijke aanpak omvat de reactie tussen koperoxide (CuO) of koperhydroxide (Cu(OH)2) met salpeterzuur (HNO3) . Bij het bereiden van kopernitraat kan men langzaam koperoxide of koperhydroxide toevoegen aan een oplossing van salpeterzuur, wat leidt tot de vorming van kopernitraat en water.
Een andere methode omvat de reactie tussen metallisch koper (Cu) en geconcentreerd salpeterzuur. Het metaal Cu reageert met salpeterzuur en produceert kopernitraat, stikstofdioxide (NO2) en water. Deze methode vereist een zorgvuldige behandeling vanwege de vorming van giftig stikstofdioxidegas.
Als alternatief kunt u metallisch koper of koperoxide oplossen in een mengsel van salpeterzuur en waterstofperoxide (H2O2) om kopernitraat te produceren. Deze methode zorgt voor een snellere reactie en produceert zuiver kopernitraat.
Ten slotte kan de dubbele verdringingsreactie tussen CuSO4 en natriumnitraat (NaNO3) ook kopernitraat produceren. Door deze twee zouten in water te mengen, slaat het kopernitraat neer en blijft het bijproduct natriumsulfaat opgelost.
Volg de veiligheidsmaatregelen tijdens de synthese, aangezien de betrokken chemicaliën reactiviteit vertonen. Gebruik geschikte beschermende uitrusting en gebruik de juiste laboratoriumpraktijken om een succesvolle en veilige synthese van kopernitraat te garanderen.
Gebruik van kopernitraat
Kopernitraat vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Enkele opmerkelijke toepassingen zijn onder meer:
- Katalysator: Het fungeert als katalysator bij de organische synthese en vergemakkelijkt reacties zoals de omzetting van alcoholen in aldehyden of ketonen.
- Pyrotechniek: Kopernitraat is een belangrijk onderdeel van pyrotechnische formuleringen en draagt bij aan de blauwe en groene kleuren van vlammen.
- Landbouw: In de landbouw dient het als een bron van koper in meststoffen om essentiële voedingsstoffen aan planten te leveren.
- Oxidatiemiddel: Kopernitraat oxideert actief andere stoffen tijdens chemische processen.
- Metaalplateren: Kopernitraat zet tijdens galvaniseerprocessen actief een dunne laag Cu af op verschillende metalen oppervlakken.
- Pigmenten en kleurstoffen: Kopernitraat draagt actief bij aan de creatie van groene en blauwe pigmenten voor keramiek, glas en textiel.
- Fotografische processen: kopernitraat draagt actief bij aan de beeldontwikkeling in bepaalde fotografische oplossingen.
- Conservering: Het vindt toepassing bij het conserveren van hout door conserveermiddelen te helpen fixeren.
- Bereiding van andere koperverbindingen: Het dient als voorloper voor de synthese van verschillende op koper gebaseerde materialen en verbindingen.
De veelzijdigheid en reactiviteit van kopernitraat maken het tot een waardevolle chemische stof op allerlei gebieden, van industriële processen tot artistieke toepassingen.
Vragen:
Vraag: Wat gebeurt er als kopernitraat wordt verwarmd?
A: Bij verhitting ontleedt kopernitraat in koperoxide, stikstofdioxidegas en zuurstof.
Vraag: Is kopernitraat oplosbaar in water?
A: Ja, kopernitraat is matig oplosbaar in water.
Vraag: Wat is de chemische formule van kopernitraat?
A: De chemische formule voor kopernitraat is Cu(NO3)2.
Vraag: Is kopernitraat een sterke elektrolyt?
A: Ja, kopernitraat is een krachtig elektrolyt, dat zich in ionen dissocieert wanneer het in water wordt opgelost.
Vraag: Wat is de lading van kopernitraat?
A: Kopernitraat heeft een netto lading van 0; het is een neutrale verbinding.
Vraag: Hoeveel stikstofatomen zitten er in 10,2 g koper(II)nitraat?
A: Er zijn ongeveer 0,161 mol koper(II)nitraat en daarom ongeveer 0,322 mol stikstofatomen.
Vraag: Hoeveel zilver kan er worden geproduceerd uit 3,00 mol koper en 3,85 mol zilvernitraat?
A: Er kan 342,3 g zilver worden geproduceerd volgens de uitgebalanceerde chemische vergelijking.
Vraag: Is kopernitraat oplosbaar?
A: Ja, kopernitraat is oplosbaar in water.
Vraag: Wat is de formule voor koper(II)nitraat?
A: De formule voor koper(II)nitraat is Cu(NO3)2.
Vraag: Wat levert de vervangingsreactie van Cu(NO3)2 en Zn op?
A: Zinknitraat (Zn(NO3)2) en kopermetaal (Cu) worden geproduceerd tijdens de vervangingsreactie.
Vraag: Wat is Cu(NO3)2?
A: Cu(NO3)2 is de chemische formule voor kopernitraat, een blauwe kristallijne verbinding.
Vraag: Welke van de volgende wordt gereduceerd in de volgende reactie? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
A: Koper (Cu) wordt tijdens de reactie gereduceerd, waarbij elektronen worden verkregen om metallisch koper te vormen.
Vraag: Vormt zich een vast Cu(OH)2 wanneer 0,075 g KOH wordt opgelost in 1,0 L Cu(NO3)2 1,0 × 10⁻³ M?
A: Nee, er ontstaat geen vast Cu(OH)2 omdat Cu(NO3)2 in oplossing volledig ioniseert en er een overmaat aan OH⁻-ionen uit KOH ontstaat.
