Koperjodide (CuI) is een felgele chemische verbinding. Het ontstaat wanneer koper reageert met jodium en wordt gebruikt in verschillende toepassingen, waaronder organische synthese en katalyse.
| IUPAC-naam | Koper(I)jodide |
| Moleculaire formule | CuI |
| CAS-nummer | 7681-65-4 |
| Synoniemen | Koperjodide, kopermonojodide, koperjodide (1:1) |
| InChi | InChI=1S/Cu.HI/h;1H/q+1;/p-1 |
Eigenschappen van koperjodide
Koperjodide-formule
De chemische formule voor koperjodide is CuI. Dit geeft aan dat elke eenheid cuprojodide bestaat uit één koper- (Cu)-atoom en één jodium-(I)-atoom. Deze eenvoudige formule vertegenwoordigt de stoichiometrie van de verbinding.
Molaire massa koperjodide
De molaire massa van koperjodide (CuI) kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Koper heeft een molaire massa van ongeveer 63,55 g/mol, terwijl jodium een molaire massa heeft van ongeveer 126,90 g/mol. De molaire massa van CuI is dus ongeveer 190,45 g/mol.
Kookpunt van koperjodide
Koperjodide heeft geen goed gedefinieerd kookpunt, omdat het ontleding ondergaat voordat het zijn kookpunt bereikt. Bij verhitting valt het uiteen in metallisch koper en gasvormig jodium, waardoor het ongeschikt is voor traditionele kookpuntbepaling.
Smeltpunt van koperjodide
Het smeltpunt van cuprojodide is relatief laag vergeleken met veel andere metaalhalogeniden. Het smeltpunt ligt rond 606 graden Celsius (1.123 graden Fahrenheit). Bij deze temperatuur verandert vast koperjodide in een gesmolten vloeistof.
Dichtheid van koperjodide g/ml
Cuprojodide heeft een dichtheid van ongeveer 5,67 g/ml. Deze waarde vertegenwoordigt de massa koperjodide per volume-eenheid. Dit geeft aan dat cuprojodide relatief dicht is in vergelijking met sommige andere anorganische verbindingen.
Koperjodide Molecuulgewicht
Het molecuulgewicht van cuprojodide, ook wel molmassa genoemd, bedraagt ongeveer 190,45 g/mol. Het is de som van de atoomgewichten van alle atomen die aanwezig zijn in een molecuul koperjodide (CuI).
Structuur van koperjodide
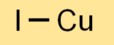
Koperjodide bestaat in verschillende kristalstructuren, waaronder alfa-, bèta- en gammafasen. De meest voorkomende vorm is de alfafase, die een zinkmengselstructuur heeft. Het vormt een netwerk van koper- en jodiumatomen.
Oplosbaarheid van koperjodide
De oplosbaarheid van cuprojodide in verschillende oplosmiddelen varieert. Het is slecht oplosbaar in water en de oplosbaarheid ervan kan worden verhoogd door jodide-ionen toe te voegen. Organische oplosmiddelen zoals ethanol kunnen het effectiever oplossen dan water.
| Verschijning | Heldergele vaste stof |
| Soortelijk gewicht | 5,67 g/ml |
| Kleur | GEEL |
| Geur | Geurloos |
| Molaire massa | 190,45 g/mol |
| Dikte | 5,67 g/cm³ |
| Fusie punt | 606°C (1123°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ethanol en ether |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet toepasbaar |
Houd er rekening mee dat sommige eigenschappen, zoals vlampunt, dampdruk, dampdichtheid, pKa en pH, vanwege de aard en eigenschappen ervan niet van toepassing of beschikbaar zijn voor koperjodide.
Veiligheid en gevaren van koperjodide
Cuprojodide brengt bepaalde veiligheidsrisico’s met zich mee waarmee bij het hanteren rekening moet worden gehouden. Het is essentieel om geschikte persoonlijke beschermingsmiddelen (PBM’s) te dragen, zoals handschoenen en een veiligheidsbril, om contact met de huid en ogen te voorkomen. Het inademen van stof of dampen moet worden vermeden, aangezien dit irritatie van de luchtwegen kan veroorzaken. Koperjodide is matig giftig bij inslikken en mag niet worden geconsumeerd. Bovendien is het essentieel om met koperjodide te werken in een goed geventileerde ruimte om dampophoping te voorkomen. Een goede opslag in goed gesloten containers, uit de buurt van onverenigbare stoffen, is van cruciaal belang om potentiële gevaren tot een minimum te beperken.
| Gevarensymbolen | Irriterend |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Matig giftig bij inslikken. Vermijd inademing. Gebruik in een goed geventileerde ruimte. Draag geschikte PBM’s. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | Niet toepasbaar |
| Gevarenklasse | Niet toepasbaar |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Matig giftig bij inslikken |
Methoden voor de synthese van koperjodide
Cuprojodide kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke methode voor het synthetiseren van koperjodide omvat het mengen van fijn verpulverd Cu met jodium en het verwarmen van het mengsel in een gecontroleerde omgeving. Naarmate de temperatuur stijgt, reageert Cu met jodium en vormt koperjodide.
Een andere benadering is om koperoxide (CuO) of koperhydroxide (Cu(OH)2) toe te voegen aan waterstofjodidezuur (HI) en het mengsel te verwarmen. De reactie tussen het zuur en de koperverbinding resulteert in de vorming van cuprojodide.
Cuprojodide kan ook worden verkregen door een Cu-zout, zoals CuS04 , te mengen met een oplosbaar jodidezout zoals kaliumjodide (KI) in water. Deze reactie leidt tot het neerslaan van cuprojodide.
Bovendien geeft een dubbele verdringingsreactie tussen een oplosbaar Cu-zout zoals kopersulfaat en een oplosbaar jodidezout zoals natriumjodide (NaI) in een waterige oplossing vast koperjodide als neerslag. .
Deze synthesemethoden bieden verschillende routes voor het verkrijgen van cuprojodide, waardoor het kan worden gebruikt in een breed scala aan toepassingen in de chemie en de industrie.
Gebruik van koperjodide
Cuprojodide vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen op verschillende gebieden. Hier zijn enkele van de belangrijkste toepassingen:
- Organische synthese: Koperjodide dient als katalysator bij organische reacties en bevordert verschillende koppelingsreacties, zoals de Ullmann-, Sonogashira- en Glaser-reacties.
- Halfgeleiders: Het wordt gebruikt bij de productie van halfgeleiders, vooral als halfgeleidermateriaal van het P-type.
- Fotovoltaïsche apparaten: Koperjodide wordt gebruikt in zonnecellen en fotodetectoren vanwege de fotogeleidings- en lichtabsorptie-eigenschappen.
- Galvaniseren: Het wordt gebruikt als elektrolytisch additief in galvaniseerbaden om de koperafzetting te verbeteren.
- Pigmenten: De heldergele kleur van cuprojodide maakt het waardevol als pigment in de keramische en glasindustrie.
- Aangroeiwerende verf: Het is een essentieel onderdeel van aangroeiwerende verven voor maritieme toepassingen.
- Chemische reagentia: Koperjodide wordt in laboratoria gebruikt als chemisch reagens voor verschillende tests en experimenten.
- Röntgencontrastmiddelen: Bij medische beeldvorming worden koperjodide-contrastmiddelen gebruikt voor röntgenonderzoek.
- Houtverduurzamingsmiddel: Koperjodide beschermt hout tegen rot en insectenplagen, waardoor het nuttig is in de houtindustrie.
- Fungiciden: Het werkt als een effectief fungicide en beschermt gewassen en planten tegen schimmelinfecties.
De talrijke toepassingen van koperjodide demonstreren het belang ervan in veel industrieën, variërend van elektronica en fotovoltaïsche zonne-energie tot landbouw en geneeskunde.
Vragen:
Vraag: Hoe koperjodide maken?
A: Koperjodide kan worden gesynthetiseerd door metallisch koper of koperoxide te laten reageren met jodium of door dubbele verdringingsreacties met behulp van kopersulfaat en kaliumjodide.
Vraag: Is koperjodide oplosbaar in water?
A: Nee, koperjodide (CuI2) is onoplosbaar in water.
Vraag: Wat is de moleculaire vergelijking voor de reactie van koper II-nitraat en kaliumjodide?
A: De moleculaire vergelijking is Cu(NO3)2 + 2KI → CuI2 + 2KNO3.
Vraag: Wat is de formule voor koperjodide?
A: De formule voor koperjodide is CuI2.
Vraag: Is koper(II)jodide onoplosbaar?
A: Ja, cupro(II)jodide (CuI2) is onoplosbaar in water.
Vraag: Is het veilig om kopersulfaat en kaliumjodide te mengen?
A: Het mengen van CaSO4 en kaliumjodide kan cuprojodide produceren, maar voorzichtigheid is geboden vanwege de reactiviteit van de betrokken chemicaliën.
Vraag: Wat is de naam van de verbinding met formule CUI2?
A: De verbinding met de formule CUI2 is cupro(II)jodide.
Vraag: Is CUI2 een neerslag?
A: Ja, CUI2 kan bij sommige reacties een neerslag vormen vanwege de lage oplosbaarheid in water.
Vraag: Is CUI2 oplosbaar in water?
A: Nee, CUI2 is niet oplosbaar in water.
Vraag: Is CUI2 oplosbaar?
A: Nee, CUI2 is niet oplosbaar in de meeste gangbare oplosmiddelen.
Vraag: Wat maakt CUI2 hardnekkig?
A: De lage oplosbaarheid van CUI2 is te wijten aan de sterke ionische binding tussen koper en jodium, wat leidt tot beperkte dissociatie in water.
