Koperhydroxide (Cu(OH)2) is een blauwe vaste stof die wordt gevormd door de reactie van koperzouten met hydroxide-ionen. Het wordt gebruikt als fungicide en in verschillende chemische processen.
| IUPAC-naam | Koper(II)hydroxide |
| Moleculaire formule | Cu(OH)2 |
| CAS-nummer | 20427-59-2 |
| Synoniemen | Koperhydroxide; Koperdihydroxide; CuOH2 |
| InChi | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Eigenschappen van koperhydroxide
Koperhydroxideformule
De chemische formule voor koperhydroxide is Cu(OH)2. Het vertegenwoordigt de combinatie van een koperion (Cu2+) en twee OH-ionen die bij elkaar worden gehouden door ionische bindingen. Deze blauwe vaste stof wordt vanwege zijn unieke eigenschappen veel gebruikt in verschillende industrieën.
Molaire massa koperhydroxide
De molaire massa van koperhydroxide (Cu(OH)2) kan worden berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. Koper (Cu) heeft een atoommassa van ongeveer 63,55 g/mol en elk OH-ion heeft een gecombineerde atoommassa van ongeveer 17,01 g/mol. De molaire massa van koperhydroxide bedraagt daarom ongeveer 97,55 g/mol.
Kookpunt van koperhydroxide
Koperhydroxide heeft geen duidelijk kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting ondergaat het een thermische ontledingsreactie waarbij koperoxide en waterdamp worden gevormd.
Smeltpunt van koperhydroxide
Koperhydroxide heeft een smeltpunt van ongeveer 200°C (392°F). Bij deze temperatuur ondergaat de vaste stof een faseovergang en verandert in een vloeibare toestand.
Dichtheid van koperhydroxide g/ml
De dichtheid van koperhydroxide is ongeveer 3,36 g/ml. Deze waarde vertegenwoordigt de massa van één milliliter koperhydroxide, wat de compactheid en concentratie aangeeft.
Moleculair gewicht van koperhydroxide
Het molecuulgewicht van koperhydroxide is ongeveer 97,55 g/mol. Het wordt berekend door de atoomgewichten van alle atomen in een koperhydroxidemolecuul op te tellen.
Structuur van koperhydroxide
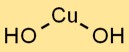
Koperhydroxide neemt een kristallijne structuur aan, met Cu2+-ionen omgeven door OH-ionen in een trigonale vlakke opstelling. Deze kristalroosteropstelling draagt bij aan de stabiliteit en onderscheidende eigenschappen.
Oplosbaarheid van koperhydroxide
Koperhydroxide heeft een beperkte oplosbaarheid in water. Het vormt een suspensie die slecht oplosbaar is in water, wat betekent dat slechts een kleine hoeveelheid van de verbinding in het oplosmiddel oplost. De oplosbaarheid kan worden beïnvloed door factoren zoals temperatuur en pH.
| Verschijning | Stevig blauw |
| Soortelijk gewicht | ~3,36 g/ml |
| Kleur | Blauw |
| Geur | Geurloos |
| Molaire massa | ~97,55 g/mol |
| Dikte | ~3,36 g/ml |
| Fusie punt | ~200°C (392°F) |
| Kookpunt | Ontbonden |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Beperkt, varieert afhankelijk van de temperatuur en de pH-waarde |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | Alkalisch (basisch) |
Veiligheid en gevaren van koperhydroxide
Koperhydroxide brengt bepaalde veiligheids- en gevaaroverwegingen met zich mee. Over het algemeen wordt aangenomen dat het weinig giftig is, maar het kan bij contact of inademing irritatie van de huid, ogen en luchtwegen veroorzaken. Bij het hanteren van deze verbinding moeten adequate beschermende maatregelen worden genomen, zoals het dragen van handschoenen en een veiligheidsbril. Als inslikken of accidentele blootstelling plaatsvindt, is onmiddellijke medische aandacht vereist. Bovendien moet koperhydroxide worden bewaard in een veilige, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Om besmetting van het milieu te voorkomen, moeten de juiste verwijderingsprocedures worden gevolgd. Het volgen van veiligheidsmaatregelen is van cruciaal belang om de potentiële risico’s van koperhydroxide tot een minimum te beperken.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Lage toxiciteit; Irriterend |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2825.90.5000 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet geclassificeerd |
| Toxiciteit | Zwak |
Synthesemethoden voor koperhydroxide
Er zijn verschillende actieve methoden voor het synthetiseren van koperhydroxide.
Een gebruikelijke aanpak omvat de reactie van een Cu-zout, zoals CuSO4 , met een sterke base zoals natriumhydroxide (NaOH) of kaliumhydroxide (KOH) . Tijdens dit proces verdringen hydroxide-ionen (OH-) van de base de sulfaationen (SO4^2-) in het CuSO4 , waardoor koperhydroxide (Cu(OH)2) ontstaat als een blauw neerslag.
Een andere methode omvat de reactie van een koper(II)zout met ammoniak (NH3). Door ammoniak aan een Cu(II)-oplossing toe te voegen, slaat cuprihydroxide neer als gevolg van de combinatie van Cu2+-ionen met de hydroxide-ionen van ammoniak.
Elektrolyse maakt de synthese van koperhydroxide mogelijk door een Cu-elektrode in een elektrolytoplossing onder te dompelen en een gelijkstroom aan te leggen. Reductie van water aan de kathode genereert hydroxide-ionen, wat leidt tot de vorming van koperhydroxide.
Deze actieve synthesemethoden bieden gecontroleerde en efficiënte manieren om koperhydroxide te produceren voor verschillende industriële en onderzoekstoepassingen.
Gebruik van koperhydroxide
Koperhydroxide vindt meerdere toepassingen in verschillende industrieën vanwege zijn unieke eigenschappen en veelzijdige karakter. Enkele opmerkelijke toepassingen zijn onder meer:
- Fungicide: Boeren gebruiken het op grote schaal als een beschermend fungicide om schimmelziekten in gewassen zoals fruit, groenten en sierplanten onder controle te houden.
- Chemische tussenproducten: Het dient als een waardevol chemisch tussenproduct bij de synthese van verschillende koperverbindingen, zoals koperoxide en koperzouten.
- Houtbeschermingsmiddel: Het behandelt hout en biedt bescherming tegen houtetende insecten en rotveroorzakende schimmels, waardoor de levensduur van houten constructies wordt verlengd.
- Antibacterieel middel: In sommige formuleringen werkt het als een antibacterieel middel en vindt het toepassingen in medische en gezondheidszorgomgevingen.
- Aquatische behandeling: Het helpt algen en wateronkruiden in vijvers, meren en andere waterlichamen te beheersen, waardoor het ecologische evenwicht behouden blijft.
- Keramiek- en glasindustrie: Fabrikanten gebruiken het als kleurstof om levendige blauwe en groene tinten aan keramische en glasproducten te geven.
- Pyrotechniek: Het draagt bij aan de kleuring van vuurwerk en fakkels en speelt een rol bij pyrotechnische toepassingen.
- Batterijproductie: Het vindt zijn toepassing bij de productie van batterijen als elektrodemateriaal, waardoor energieopslag wordt vergemakkelijkt.
- Verf en coatings: Sommige verfformuleringen bevatten het om beschermende en antimicrobiële eigenschappen te verlenen.
De diversiteit aan toepassingen benadrukt het belang van koperhydroxide in meerdere industrieën, waardoor het een waardevolle verbinding is voor verschillende praktische toepassingen.
Vragen:
Vraag: Is koperhydroxide oplosbaar?
A: Koperhydroxide heeft een beperkte oplosbaarheid in water en vormt een slecht oplosbare suspensie.
Vraag: Hoeveel mol zit er in 68 gram koper(II)hydroxide Cu(OH)2?
A: Er zit ongeveer 0,697 mol Cu(OH)2 in 68 gram.
Vraag: Is koper II-hydroxide oplosbaar in water?
A: Cupri II-hydroxide heeft een beperkte oplosbaarheid in water.
Vraag: Zijn natriumhydroxide en kopersulfaat een chemische reactie?
A: Ja, de reactie tussen NaOH en CuSO4 resulteert in de vorming van koperhydroxide en natriumsulfaat.
Vraag: Is koper(II)hydroxide oplosbaar?
A: Koper(II)hydroxide heeft een beperkte oplosbaarheid in water.
Vraag: Wat is de kleur van koperhydroxide?
A: Koperhydroxide is blauw van kleur.
Vraag: Is koperhydroxide een alkali?
A: Koperhydroxide is een base, maar wordt niet geclassificeerd als een alkali.
Vraag: Is koperhydroxide een sterke base?
A: Koperhydroxide wordt niet als een sterke base beschouwd.
Vraag: Is Cu(OH)2 oplosbaar in water?
A: Cu(OH)2 heeft een beperkte oplosbaarheid in water.
Vraag: Hoeveel mol zit er in 68 gram koper(II)hydroxide Cu(OH)2?
A: Er zit ongeveer 0,697 mol Cu(OH)2 in 68 gram.
Vraag: Hoeveel mol zit er in 34 gram Cu(OH)2?
A: Er zit ongeveer 0,3485 mol Cu(OH)2 in 34 gram.
Vraag: Vormt zich een vaste Cu(OH)2 wanneer 0,075 g KOH wordt opgelost in 1,0 L Cu(NO3)2 bij 1,0 × 10^−3 M?
A: Ja, vast Cu(OH)2 vormt zich als neerslag als gevolg van de reactie tussen KOH en Cu(NO3)2.
