Koperfluoride (CuF2) is een verbinding gemaakt van koper en fluor. Het vertoont een groenachtig blauwe kleur en vindt toepassingen in verschillende industrieën, waaronder elektronica en katalyse.
| IUPAC-naam | Koper(II)fluoride |
| Moleculaire formule | CuF2 |
| CAS-nummer | 7789-19-7 |
| Synoniemen | Koperfluoride, Koperdifluoride |
| InChi | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Eigenschappen van koperfluoride
Koperfluoride-formule
De formule voor koperdifluoride is CuF2. Het bestaat uit één koperatoom (Cu) en twee fluoratomen (F). Deze ionische verbinding vormt een stabiele kristalstructuur dankzij de elektrostatische aantrekkingskracht tussen het positief geladen koperion en de negatief geladen fluoride-ionen.
Koperfluoride molaire massa
De molaire massa van koperdifluoride (CuF2) wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Koper heeft een molaire massa van ongeveer 63,55 g/mol en fluor heeft een molaire massa van ongeveer 18,99 g/mol. Als we ze bij elkaar optellen, krijgen we een molaire massa van koperdifluoride van ongeveer 101,09 g/mol.
Kookpunt van koperfluoride
Koperdifluoride heeft geen goed gedefinieerd kookpunt, omdat het ontleding ondergaat voordat het een kookpunt bereikt. Bij hoge temperaturen begint koperdifluoride te ontleden in koperdifluoride (CuF) en fluorgas (F2). Daarom wordt het als thermisch instabiel beschouwd.
Smeltpunt van koperfluoride
Koperdifluoride heeft een smeltpunt van ongeveer 840°C (1544°F). Bij deze temperatuur absorberen vaste koperdifluoridekristallen voldoende energie om over te gaan naar een gesmolten toestand, waardoor ze kunnen worden gebruikt in een verscheidenheid aan toepassingen bij hoge temperaturen.
Dichtheid van koperfluoride g/ml
De dichtheid van koperdifluoride is ongeveer 4,23 g/ml. Deze dichtheidswaarde geeft aan dat koperdifluoride een relatief dicht materiaal is, wat nuttig kan zijn in specifieke toepassingen waarbij een hoge dichtheid vereist is.
Molecuulgewicht koperfluoride
Het molecuulgewicht van koperdifluoride (CuF2) is ongeveer 101,09 g/mol. Het wordt berekend door de atoomgewichten van koper en twee fluoratomen in de formule op te tellen.
Structuur van koperfluoride
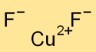
Koperdifluoride neemt een kristalstructuur aan en vormt een netwerkachtige opstelling van Cu2+-kationen en F-anionen. De koperkationen zijn omgeven door zes fluoride-ionen en elk fluoride-ion staat in contact met drie koperionen.
Oplosbaarheid van koperfluoride
Koperdifluoride heeft een lage oplosbaarheid in water. Het vormt slecht oplosbare zouten die Cu2+- en F–ionen in de oplossing afgeven. Deze eigenschap is belangrijk bij verschillende chemische processen en toepassingen, waaronder anorganische synthese en elektrochemische toepassingen.
| Verschijning | Groenachtig blauwe vaste stof |
| Soortelijk gewicht | 4,23 g/ml |
| Kleur | groenachtig blauw |
| Geur | Geurloos |
| Molaire massa | 101,09 g/mol |
| Dikte | 4,23 g/cm³ |
| Fusie punt | 840°C (1544°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zwak, vormt slecht oplosbare zouten |
| Oplosbaarheid | Slecht oplosbaar |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Veiligheid en gevaren van koperfluoride
Koperdifluoride brengt verschillende veiligheids- en risicooverwegingen met zich mee. Direct contact met de verbinding kan huid- en oogirritatie veroorzaken. Het inademen van het stof of de dampen ervan kan ademhalingsproblemen veroorzaken. Bij verhitting kan er giftig fluorgas vrijkomen, wat schadelijk is bij inademing. Daarom moeten adequate ventilatie en persoonlijke beschermingsmiddelen worden gebruikt bij het hanteren van koperdifluoride. Bovendien is het essentieel om inname te vermijden, omdat dit kan leiden tot maag-darmklachten. De verbinding moet worden bewaard in afgesloten containers, uit de buurt van onverenigbare materialen, om reacties te voorkomen. Goede veiligheidsprotocollen en hanteringspraktijken zijn essentieel om de risico’s van koperdifluoride tot een minimum te beperken.
| Gevarensymbolen | Irriterend |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Schadelijk bij inademing. Bij verhitting kan giftig fluorgas vrijkomen. Vermijd inname. Gebruik geschikte ventilatie- en beschermende uitrusting. |
| VN-identificatienummers | N.v.t |
| HS-code | 2826.92.00 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Giftig |
Methoden voor de synthese van koperfluoride
Er zijn verschillende methoden voor het synthetiseren van koperdifluoride. Een gebruikelijke aanpak is om koperoxide (CuO) of kopercarbonaat (CuCO3) aan een container toe te voegen en voorzichtig te roeren terwijl fluorwaterstofzuur (HF) aan de container wordt toegevoegd. De reactie gaat door en produceert koperdifluoride en water als bijproducten.
Een andere methode omvat het laten reageren van metallisch koper of koperpoeder met fluorgas (F2) bij hoge temperaturen. Dit proces vereist een zorgvuldige behandeling vanwege de reactiviteit van fluorgas. Het vormt koperdifluoride rechtstreeks door de combinatie van koper- en fluoratomen.
Bovendien kan de bereiding van koperdifluoride plaatsvinden door koper(II)chloride (CuCl2) te laten reageren met natriumfluoride (NaF) in een waterige oplossing. De reactie produceert zowel koperdifluoride als natriumchloride als bijproduct.
Deze synthesemethoden vereisen veiligheidsmaatregelen en geschikte apparatuur vanwege de reactiviteit van sommige van de betrokken chemicaliën. Nauwkeurige controle van de reactieomstandigheden is cruciaal om hoge opbrengsten aan zuiver koperdifluoride te verkrijgen.
Gebruik van koperfluoride
Koperdifluoride vindt een reeks waardevolle toepassingen vanwege zijn unieke eigenschappen en kenmerken. Hier zijn enkele belangrijke toepassingen:
- Elektronica: Koperdifluoride wordt in de halfgeleiderindustrie gebruikt als bron van koperionen voor dunnefilmdepositieprocessen. Het fungeert als een pionier in de productie van elektronische apparaten en geïntegreerde schakelingen.
- Katalyse: Het fungeert als katalysator bij verschillende chemische reacties, waaronder de synthese van organische verbindingen en bij industriële processen zoals fluoreringsreacties.
- Fluorbron: Koperdifluoride wordt gebruikt om fluorgas (F2) te produceren door ontleding bij hoge temperaturen, wat essentieel is voor verschillende industriële toepassingen.
- Keramiek en glas: De verbinding wordt gebruikt als additief bij de productie van keramiek en glas om de eigenschappen van het materiaal te wijzigen en de prestaties ervan te verbeteren.
- Tandheelkundige materialen: Koperdifluoride wordt verwerkt in tandheelkundige producten, zoals tandpasta en mondwater, om hun anti-gaatjes en antibacteriële eigenschappen te verbeteren.
- Coatings: Het wordt gebruikt in speciale coatings, zoals antireflecterende coatings voor optische apparaten en beschermende coatings voor metalen oppervlakken.
- Vlamvertragers: Koperdifluoride wordt gebruikt als additief in vlamvertragende materialen, waardoor de ontvlambaarheid van verschillende producten wordt verminderd.
- Chemisch reagens: In laboratoria en onderzoek wordt koperdifluoride gebruikt als reagens bij specifieke chemische reacties en analyses.
De veelzijdigheid van koperdifluoride maakt het waardevol in alle sectoren, van de elektronica tot de gezondheidszorg, waar de unieke eigenschappen worden benut om de prestaties en veiligheid te verbeteren. Een juiste hantering en veiligheidsmaatregelen zijn echter essentieel vanwege de reactiviteit en de potentiële gevaren.
Vragen:
Vraag: Wat is de massaformule van koper(II)fluoride?
A: De formulemassa van koper(II)difluoride (CuF2) is ongeveer 101,09 g/mol.
Vraag: Welke van de volgende is de juiste formule voor koper(II)fluoride?
A: De juiste formule voor koper(II)difluoride is CuF2.
Vraag: Maakt koper fluoride schoon?
A: Nee, koper reinigt difluoride niet. Koper heeft niet het vermogen om difluoride uit water te verwijderen.
Vraag: Wat is de covalente verbinding van NaCl, KCl, CuF2 en CF4?
A: De covalente verbinding is CF4 (tetrafluorkoolstof).
Vraag: Wat wordt er gevormd aan de elektroden als een waterige oplossing van CuF2 wordt geëlektrolyseerd?
A: Aan de anode wordt gasvormig zuurstof (O2) gevormd en aan de kathode metallisch koper (Cu).
Vraag: Wat is de naam van CuF2 in het Stock-systeem?
A: De naam van CuF2 in het Stock-systeem is koper(II)difluoride.
Vraag: Wat is de lading van het koperion in de verbinding CuF2?
A: De lading van het koperion in CuF2 is +2.
Vraag: Is CuF2 ionisch of moleculair?
A: CuF2 is een ionische verbinding.
Vraag: Wat is de lading van de ionische verbinding CuF2?
A: De ionische verbinding CuF2 is neutraal.
Vraag: Wat is de naam van de verbinding met de formule CuF2?
A: De naam van de verbinding met de formule CuF2 is koper(II)difluoride.
