Kopercarbonaat (CuCO3) is een blauwgroene verbinding die op natuurlijke wijze wordt gevormd door de reactie van Cu-zouten met carbonaationen. Het heeft verschillende industriële toepassingen, waaronder pigmenten en fungiciden.
| IUPAC-naam | Koper(II)carbonaat |
| Moleculaire formule | CuCO3 |
| CAS-nummer | 1184-64-1 |
| Synoniemen | Basisch kopercarbonaat, kopercarbonaat, kopermonocarbonaat |
| InChi | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschappen van kopercarbonaat
Kopercarbonaatformule
De chemische formule voor kopercarbonaat is CuCO3. Het vertegenwoordigt een combinatie van één koperatoom (Cu), één koolstofatoom (C) en drie zuurstofatomen (O). Deze formule biedt cruciale informatie over de elementaire samenstelling van de verbinding.
Kopercarbonaat Molaire massa
Kopercarbonaat heeft een molaire massa van ongeveer 123,55 gram per mol (g/mol). De molaire massa is de som van de atoommassa’s van alle atomen die in een mol stof aanwezig zijn en wordt uitgedrukt in gram per mol.
Kookpunt van kopercarbonaat
Kopercarbonaat heeft geen duidelijk kookpunt, omdat het bij verhitting tot ongeveer 200°C uiteenvalt in CuO en koolstofdioxide. Daarom ondergaat het thermische ontleding in plaats van te koken.
Kopercarbonaat Smeltpunt
Kopercarbonaat heeft een smeltpunt van ongeveer 200°C (392°F). Bij deze temperatuur verandert het vaste kopercarbonaat in de vloeibare toestand. Er moet echter worden opgemerkt dat het ontleedt voordat het zijn kookpunt bereikt.
Dichtheid van kopercarbonaat g/ml
De dichtheid van kopercarbonaat is ongeveer 3,6 gram per milliliter (g/ml). Dichtheid meet de massa van een stof per volume-eenheid en geeft aan hoe dicht de deeltjes op elkaar zijn gepakt.
Kopercarbonaat Molecuulgewicht
Het molecuulgewicht van kopercarbonaat, ook wel molmassa genoemd, is ongeveer 123,55 g/mol. Deze waarde is cruciaal voor verschillende chemische berekeningen en conversies.
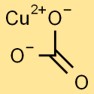
Structuur van kopercarbonaat
Kopercarbonaat heeft een trigonale vlakke structuur. Het centrale koperatoom is omgeven door drie zuurstofatomen en een carbonaatgroep, bestaande uit één koolstofatoom en drie aan elkaar gebonden zuurstofatomen.
Oplosbaarheid van kopercarbonaat
Cupricarbonaat is slecht oplosbaar in water, waardoor het slechts in beperkte mate oplost. De oplosbaarheid wordt beïnvloed door factoren zoals temperatuur en pH. Het reageert met zuren en vormt koperzouten, waarbij kooldioxide vrijkomt.
| Verschijning | Blauwgroene vaste stof |
| Soortelijk gewicht | ~3,6 g/ml |
| Kleur | Blauw groen |
| Geur | Geurloos |
| Molaire massa | ~123,55 g/mol |
| Dikte | ~3,6 g/ml |
| Fusie punt | ~200°C (392°F) |
| Kookpunt | Ontleedt bij ~200°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar, beïnvloed door temperatuur en pH |
| Oplosbaarheid | Onoplosbaar in de meeste oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch (basisch) |
Veiligheid en gevaren van kopercarbonaat
Kopercarbonaat brengt bepaalde veiligheids- en gevaaroverwegingen met zich mee. Het is essentieel om er voorzichtig mee om te gaan om mogelijke risico’s te voorkomen. Direct contact met de huid, ogen of inademing van stof kan irritatie en ongemak veroorzaken. Langdurige blootstelling of inname kan schadelijk zijn en tot ernstigere gezondheidsproblemen leiden. Bij verhitting kunnen giftige dampen vrijkomen, waaronder kooldioxide, waarvoor voldoende ventilatie nodig is. Bovendien is kopercarbonaat in poedervorm ontvlambaar, waardoor zorgvuldige opslag en hantering vereist is om brandgevaar te voorkomen. Om de veiligheid te garanderen, dient u altijd de veiligheidsmaatregelen te volgen, geschikte beschermende uitrusting te dragen en verbindingen uit de buurt van incompatibele materialen op te slaan.
| Gevarensymbolen | Irriterend, gevaarlijk |
| Beveiligingsbeschrijving | Breekbaar. Vermijd direct contact. Gebruik in goed geventileerde ruimtes. Volg de veiligheidsinstructies en draag beschermende uitrusting. |
| VN-identificatienummers | Niet toegeschreven |
| HS-code | 2836.40.0000 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit; kan bij contact irritatie en ongemak veroorzaken; vermijd inname en inademing. |
Methoden voor de synthese van kopercarbonaat
Er zijn verschillende methoden voor het synthetiseren van kopercarbonaat, die allemaal de combinatie van Cu-zouten met carbonaatbronnen omvatten. Een gebruikelijke aanpak is om CuSO4 te laten reageren met natriumcarbonaat (Na2CO3) in een waterige oplossing. Deze reactie produceert een neerslag van kopercarbonaat, en filtratie scheidt dit af, gevolgd door drogen om het vaste product te verkrijgen.
Een andere methode omvat de reactie van CuCl2 met natriumcarbonaat of natriumbicarbonaat (NaHCO3) in een soortgelijk waterig milieu. Deze reactie produceert kopercarbonaat en natriumchloride (NaCl) als bijproduct.
Bovendien vormt het borrelen van kooldioxide (CO2) door een Cu(OH)2-oplossing bij hydroxide-omzetting een kopercarbonaatneerslag.
Het metaal Cu interageert met kooldioxidegas in een gecontroleerde omgeving om kopercarbonaat te produceren.
Het beheersen van de reactieomstandigheden, zoals temperatuur en concentratie, wordt cruciaal voor het bereiken van de gewenste opbrengsten en zuiverheid. Deze methoden bieden de middelen om kopercarbonaat te produceren voor verschillende industriële toepassingen, waaronder het gebruik ervan als pigment, fungicide of in andere chemische processen.
Gebruik van kopercarbonaat
Kopercarbonaat vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen van kopercarbonaat:
- Pigmenten: Kopercarbonaat geeft levendige blauwgroene tinten aan verven, keramiek en kunststoffen, waardoor hun uiterlijk wordt verbeterd.
- Landbouwfungicide: Het dient effectief als fungicide in de landbouw, beschermt gewassen tegen schimmelinfecties en bevordert een gezonde plantengroei.
- Houtbehoud: Kopercarbonaat wordt gebruikt in houtverduurzamingsformuleringen en beschermt hout tegen rotting en insectenschade.
- Galvaniseren: Het vergemakkelijkt op cruciale wijze galvaniseerprocessen, waardoor de afzetting van een kopercoating op verschillende metalen oppervlakken mogelijk wordt, waardoor de geleidbaarheid en corrosieweerstand worden verbeterd.
- Katalysator: Kopercarbonaat fungeert als een actieve katalysator bij verschillende chemische reacties, waardoor de reactiesnelheden worden versneld zonder zelf significante veranderingen te ondergaan.
- Algicide: Bij de waterbehandeling fungeert het actief als een algicide en controleert het de algengroei in tanks, vijvers en watersystemen.
- Glasproductie: Kopercarbonaat draagt actief bij aan de productie van groen getinte glasproducten zoals flessen en decoratief glaswerk in de glasindustrie.
- Kunstmatige sieraden: Bij de productie van kunstmatige sieraden wordt actief kopercarbonaat verwerkt, wat een betaalbaar alternatief biedt voor sieraden op basis van echt koper.
- Analytische chemie: kopercarbonaat wordt actief gebruikt als reagens in de analytische chemie om verschillende tests en experimenten uit te voeren.
- Vuurwerk en pyrotechniek: Het draagt actief bij aan de felgroene kleur van vuurwerk en pyrotechnische shows.
De diversiteit aan toepassingen onderstreept het belang van kopercarbonaat als een waardevolle chemische verbinding in veel industrieën, waardoor zowel producten als processen worden verbeterd.
Vragen:
Vraag: Hoeveel mol zuurstofatomen zitten er in 5,67 mol koper(II)carbonaat?
A: In 5,67 mol koper(II)carbonaat zitten 17,01 mol zuurstofatomen (3 zuurstofatomen voor 1 mol CuCO3).
Vraag: Is kopercarbonaat oplosbaar?
A: Kopercarbonaat is slecht oplosbaar in water.
Vraag: Welk element zal waarschijnlijk elektriciteit doorgeven: koper, koolstof, helium of zwavel?
A: Koper is het element dat het meest waarschijnlijk elektriciteit doorlaat, omdat het een goede geleider van elektriciteit is.
Vraag: Hoe kopercarbonaat maken?
A: Kopercarbonaat kan worden bereid door Cu-zouten te laten reageren met carbonaatbronnen, zoals natriumcarbonaat, of door kooldioxide door een oplossing van Cu(OH)2 te laten borrelen.
Vraag: Hoe gebruik ik kopercarbonaat in aardewerk?
A: Kopercarbonaat wordt in aardewerk gebruikt als keramisch glazuur om afgewerkte stukken een blauwgroene kleur te geven.
Vraag: Is CuCO3 oplosbaar in water?
A: CuCO3 is slecht oplosbaar in water.
Vraag: Hoe kun je een precipitatiereactie gebruiken om een CuCO3-monster te bereiden?
A: Om CuCO3 te bereiden door middel van een precipitatiereactie, kunt u een oplosbaar Cu-zout mengen met een oplosbaar carbonaatzout, wat leidt tot de vorming van onoplosbaar kopercarbonaat, dat kan worden gescheiden door filtratie.
Vraag: Wat is de naam van de verbinding CuCO3?
A: De verbinding CuCO3 wordt koper(II)carbonaat genoemd.
Vraag: Wat is de molaire massa van CuCO3?
A: De molaire massa van CuCO3 is ongeveer 123,55 g/mol.
Vraag: Is CuCO3 oplosbaar of onoplosbaar?
A: CuCO3 is onoplosbaar in de meeste oplosmiddelen, inclusief water.
Vraag: Waar is koper(II)carbonaat van gemaakt?
A: Koper(II)carbonaat bestaat uit één Cu-atoom, één koolstofatoom (C) en drie zuurstofatomen (O).
