Koperacetaat (Cu(CH3COO)2) is een blauwgroene kristallijne verbinding. Het wordt gevormd wanneer koper reageert met azijnzuur. Het vindt toepassingen in verschillende industrieën, zoals katalysatoren en fungiciden.
| IUPAC-naam | Koper(II)acetaat |
| Moleculaire formule | Cu(CH3COO)2 |
| CAS-nummer | 142-71-2 |
| Synoniemen | Koperacetaat, koperzout van azijnzuur, koperdiacetaat |
| InChi | InChI=1S/2C2H4O2.Cu/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van koperacetaat
Koperacetaatformule
Cupri-acetaat heeft de chemische formule Cu(CH3COO)2. Het bestaat uit een koperatoom (Cu) gebonden aan twee acetaatgroepen (CH3COO). De formule vertegenwoordigt de verhouding van elementen in de verbinding.
Molaire massa van koperacetaat
De molaire massa van koperacetaat kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Koper (Cu) heeft een molmassa van 63,55 g/mol, terwijl acetaat (CH3COO) een molmassa heeft van 59,04 g/mol. De molaire massa van cupriacetaat is dus 181,63 g/mol.
Kookpunt van koperacetaat
Cupri-acetaat ontleedt voordat het het kookpunt bereikt vanwege de thermische instabiliteit. Het kookpunt is daarom niet goed gedefinieerd. In plaats daarvan ondergaat het ontbinding bij aanzienlijke verhitting.
Smeltpunt van koperacetaat
Koperacetaat smelt doorgaans tussen 115°C en 120°C (239°F en 248°F). Het smeltpunt kan enigszins variëren, afhankelijk van de zuiverheid van de verbinding.
Dichtheid van koperacetaat g/ml
De dichtheid van cupriacetaat is ongeveer 1,882 g/ml. Deze waarde komt overeen met de massa koperacetaat per volume-eenheid. De dichtheid kan variëren als gevolg van veranderingen in temperatuur en druk.
Molecuulgewicht koperacetaat
Het molecuulgewicht van cupriacetaat, berekend op basis van de formule, is 181,63 g/mol. Het vertegenwoordigt de som van de atoomgewichten van alle atomen die aanwezig zijn in een koperacetaatmolecuul.
Structuur van koperacetaat
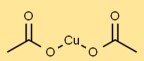
Cupri-acetaat heeft in zijn vaste vorm een kristalroosterstructuur. Koperatomen zijn gecoördineerd met acetaatgroepen en vormen een stabiele opstelling. Het ziet eruit als blauwgroene kristallen vanwege de coördinatiegeometrie.
Oplosbaarheid van koperacetaat
Cupri-acetaat heeft een matige oplosbaarheid in water. Het kan oplossen in polaire oplosmiddelen vanwege de aanwezigheid van acetaationen. De oplosbaarheid kan echter beperkt zijn en het oplossen ervan kan worden beïnvloed door temperatuur en pH.
| Verschijning | Blauwgroene kristallijne vaste stof |
| Soortelijk gewicht | 1.882 g/ml |
| Kleur | Blauw groen |
| Geur | Geurloos |
| Molaire massa | 181,63 g/mol |
| Dikte | 1.882 g/ml |
| Fusie punt | 115°C – 120°C (239°F – 248°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Matige oplosbaarheid in water |
| Oplosbaarheid | Oplosbaar in polaire oplosmiddelen, enigszins oplosbaar in ether en glycerol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Zuur (ongeveer 4-5) |
Veiligheid en gevaren van koperacetaat
Cupri-acetaat brengt bepaalde veiligheidsproblemen en gevaren met zich mee. Het is essentieel om er voorzichtig mee om te gaan en de veiligheidsprotocollen te volgen. Direct contact met de verbinding kan huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan ademhalingsproblemen veroorzaken. Vermijd inname omdat het schadelijk kan zijn. Houd het uit de buurt van onverenigbare materialen en hitte- of ontstekingsbronnen om brandgevaar te voorkomen. In geval van accidentele blootstelling, de getroffen gebieden onmiddellijk afspoelen en medische hulp inroepen. Bewaar koperacetaat in een goed geventileerde, veilige ruimte, uit de buurt van kinderen en onbevoegde personen. Gebruik altijd geschikte persoonlijke beschermingsmiddelen wanneer u met dit middel werkt.
| Gevarensymbolen | Bijtend, acuut giftig, irriterend |
| Beveiligingsbeschrijving | Vermijd direct contact met huid en ogen. Gebruik in een goed geventileerde ruimte. Breekbaar. |
| VN-identificatienummers | Niet toegeschreven |
| HS-code | 29152900 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III (laag gevaar) |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Inademing kan ademhalingsproblemen veroorzaken. Vermijd inname. |
Methoden voor de synthese van koperacetaat
Er zijn verschillende methoden voor het synthetiseren van koperacetaat.
Een gebruikelijke aanpak omvat de reactie tussen koperoxide (CuO) of koperhydroxide (Cu(OH)2) met azijnzuur (CH3COOH). Ze combineren en roeren de twee stoffen, wat leidt tot de vorming van koperacetaat en water. Een andere methode is de reactie van kopercarbonaat (CuCO3) met azijnzuur, waarbij koperacetaat, kooldioxide (CO2) en water worden geproduceerd.
Een alternatieve synthesemethode omvat de reactie van metallisch koper met een mengsel van azijnzuur en waterstofperoxide (H2O2). Deze reactie leidt tot de vorming van koperacetaat en water. Cupri-acetaat ontstaat uit de reactie tussen koper(II)sulfaat (CuSO4) en calciumacetaat (Ca(CH3COO)2. Deze reactie produceert cupri-acetaat en calciumsulfaat (CaSO4).
Door een mengsel van koperpoeder en ijsazijn te verwarmen en onder terugvloeikoeling te koken, ontstaat koperacetaat. Dit proces leidt tot de vorming van koperacetaat. De beschikbaarheid van reagentia en de gewenste zuiverheid van het eindproduct bepalen de duidelijke voordelen van elke methode.
Gebruik van koperacetaat
Koperacetaat vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen:
- Katalysator: Koperacetaat katalyseert veel organische reacties, waaronder de synthese van vinylacetaat en azijnzuuranhydride.
- Galvaniseren: Koperacetaat helpt bij galvaniseerprocessen, waardoor een dunne laag koper op metalen voorwerpen wordt aangebracht, waardoor het uiterlijk en de corrosieweerstand worden verbeterd.
- Chemische tussenproducten: De verbinding speelt een cruciale rol als tussenproduct bij de productie van verschillende chemicaliën zoals koperoxide, kopernaftenaat en koperzepen.
- Houtverduurzamingsmiddel: Koperacetaat werkt als een houtverduurzamingsmiddel en beschermt hout tegen schimmel- en insectenaanvallen, dat vaak wordt gebruikt om spoorbielzen en elektriciteitspalen te behouden.
- Fungicide: In de landbouw wordt koperacetaat gebruikt als fungicide om schimmelziekten in gewassen te bestrijden, vooral in wijngaarden en boomgaarden.
- Pyrotechniek: Koperacetaat wordt toegepast in pyrotechnische formuleringen en produceert levendige blauwe en groene kleuren in vuurwerk en vuurpijlen.
- Textielverven: Het werkt als bijtmiddel bij het verven van textiel, waardoor de hechting van kleurstoffen aan vezels wordt vergemakkelijkt.
- Laboratoriumreagens: De verbinding fungeert als reagens in laboratoriumexperimenten voor kwalitatieve en kwantitatieve analyses.
- Analytische chemie: Koperacetaat wordt gebruikt als testreagens in de analytische chemie om waterstofsulfidegas te detecteren.
- Dierenafweermiddel: Het werkt als een dierenafweermiddel om bepaalde plagen en wilde dieren uit specifieke gebieden af te schrikken.
De diverse toepassingen van koperacetaat benadrukken het belang ervan in verschillende industrieën, variërend van chemische synthese tot landbouw en daarbuiten. Zorgvuldige omgang en het volgen van veiligheidsmaatregelen zijn essentieel bij het gebruik van deze verbinding in verschillende processen.
Vragen:
Vraag: Is koper II-acetaat covalent?
A: Nee, cupriacetaat II is een ionische verbinding.
Vraag: Wat is de molaire uitdovingscoëfficiënt bij 625 nm voor deze koper II-acetaatoplossing?
A: De molaire uitdovingscoëfficiënt bij 625 nm voor een cupriacetaat II-oplossing is specifiek voor de oplossingsconcentratie en moet experimenteel worden bepaald.
Vraag: Kun je koperacetaatmonohydraat in een septic tank doen?
A: Koperacetaat-monohydraat wordt niet aanbevolen voor gebruik als septic tank- of afvoerreiniger vanwege mogelijke gevaren en milieuproblemen.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van bariumacetaat en koper (II) bromide worden gecombineerd?
A: Ja, er treedt een reactie op wanneer waterige oplossingen van bariumacetaat en cupri(II)bromide worden gecombineerd, wat resulteert in de vorming van een neerslag (bariumbromide) en oplosbaar cupriacetaat.
Vraag: Wat is het smeltpunt van koperacetaat?
A: Het smeltpunt van cupriacetaat is ongeveer 115°C tot 120°C (239°F tot 248°F).
Vraag: Hoe maak ik koperacetaat uit kopersulfaat?
A: Om koperacetaat uit CuSO4 te maken, lost u CuSO4 op in water en voegt u vervolgens azijnzuur toe aan de oplossing totdat koperacetaat neerslaat. Filter en droog het product.
Vraag: Wat is cupri-acetaat?
A: Koperacetaat is een chemische verbinding met de formule Cu(CH3COO)2. Het is een blauwgroene kristallijne vaste stof en heeft verschillende industriële toepassingen.
Vraag: Is koperacetaat oplosbaar in water?
A: Ja, cupriacetaat is matig oplosbaar in water en vormt een blauwgroene oplossing.
Vraag: Waarom is de koperacetaatoplossing troebel?
A: De koperacetaatoplossing kan troebel worden door de aanwezigheid van onzuiverheden of de vorming van onoplosbare koperverbindingen, vooral als de oplossing niet op de juiste manier wordt bereid of bewaard.
Vraag: Oxidatie van Cu(OAc)2?
A: Koper(II)acetaat (Cu(OAc)2) kan bij bepaalde reacties als oxidatiemiddel werken, waarbij het reductie ondergaat terwijl andere stoffen worden geoxideerd.
