Koolstoftetrahydride, ook bekend als methaan, is een kleurloos, geurloos, brandbaar gas met de chemische formule CH4. Het is het hoofdbestanddeel van aardgas en wordt gebruikt als brandstofbron en grondstof in veel industriële processen.
| IUPAC-naam | Methaan |
| Moleculaire formule | CH4 |
| CAS-nummer | 74-82-8 |
| Synoniemen | Moerasgas, CH4 |
| InChi | InChI=1S/CH4/h1H4 |
Eigenschappen van koolstoftetrahydride
Kooltetrahydride-formule
De chemische formule voor koolstoftetrahydride is CH4, een kleurloos, geurloos gas dat het hoofdbestanddeel van aardgas is.
Koolstoftetrahydride Molaire massa
De molaire massa van methaan is 16,04 g/mol. Dit is de massa van één mol methaanmoleculen en wordt gebruikt om het aantal moleculen in een bepaalde massa van de stof te berekenen.
Kookpunt van tetrahydridekoolstof
Het kookpunt van methaan is -162°C. Dit betekent dat bij deze temperatuur de dampspanning van methaan gelijk is aan de atmosferische druk en dat de vloeistof begint te koken.
Koolstoftetrahydride Smeltpunt
Het smeltpunt van methaan is -182,5°C. Dit is de temperatuur waarbij de vaste vorm van methaan in een vloeistof verandert.
Dichtheid van tetrahydridekoolstof g/ml
De dichtheid van methaan bij standaardtemperatuur en -druk is 0,717 g/ml. Dit betekent dat een volume van één milliliter methaan een massa heeft van 0,717 gram.
Koolstoftetrahydride Molecuulgewicht
Het molecuulgewicht van methaan is 16,04 g/mol, wat de som is van de atoomgewichten van de vier waterstofatomen en één koolstofatoom in het methaanmolecuul.
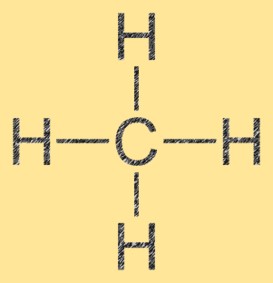
Structuur van tetrahydridekoolstof
Methaan heeft een tetraëdrische moleculaire structuur, met het koolstofatoom in het midden en de vier waterstofatomen eraan vastgemaakt. De bindingshoeken in methaan zijn 109,5° en de bindingslengtes zijn ongeveer 1,09 Å. Het molecuul is niet-polair, wat betekent dat het vanwege zijn symmetrische structuur geen permanent elektrisch dipoolmoment heeft. Methaan is een standaard temperatuur- en drukgas en wordt in veel industriële processen gebruikt als brandstofbron en grondstof.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,554 (lucht = 1) |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 16,04 g/mol |
| Dikte | 0,717 g/ml bij standaardtemperatuur en druk |
| Fusie punt | -182,5°C |
| Kookpunt | -162°C |
| Flitspunt | N.v.t |
| oplosbaarheid in water | 1,15 g/l |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | N.v.t |
| Dampdichtheid | 0,554 (lucht = 1) |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van tetrahydridekoolstof
Koolstoftetrahydride (methaan) is een brandbaar gas dat kan ontbranden of exploderen als het wordt blootgesteld aan een ontstekingsbron. In besloten ruimtes kan methaan zuurstof verdringen en verstikking veroorzaken. Methaan is ook een krachtig broeikasgas dat bijdraagt aan de klimaatverandering. Bij het omgaan met methaan is het belangrijk om de juiste veiligheidsmaatregelen te nemen en de lokale regelgeving en industrienormen te volgen.
| Gevarensymbolen | Vlam. Gas |
| Beveiligingsbeschrijving | 2/2/2 |
| VN-identificatienummers | VN1956 |
| HS-code | 2709.00.90 |
| Gevarenklasse | 2.1 |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Het inademen van hoge concentraties methaan kan verstikking veroorzaken en zuurstof verdringen in besloten ruimtes. |
Methoden voor de synthese van koolstoftetrahydride
Koolstoftetrahydride (methaan) kan op verschillende manieren worden gesynthetiseerd, waaronder biologische, chemische en thermochemische methoden. De meest gebruikelijke synthesemethode is via het biologische proces van methanogenese, waarbij micro-organismen zoals methanogene archaea en bacteriën betrokken zijn die methaan produceren als bijproduct van hun metabolisme. Bij het chemische proces kan methaan worden geproduceerd door kooldioxide te laten reageren met waterstofgas in aanwezigheid van een katalysator. Bovendien kan methaan worden geproduceerd uit steenkool of aardgas via thermochemische processen, zoals vergassing of pyrolyse. Deze methoden omvatten het verwarmen van de brandstofbron tot hoge temperaturen in afwezigheid van zuurstof, waardoor een mengsel van gassen ontstaat, waaronder methaan, dat vóór gebruik kan worden gescheiden en gezuiverd.
Gebruik van tetrahydridekoolstof
Koolstoftetrahydride (methaan) is een veelzijdige en veelgebruikte energiebron, met toepassingen in verschillende industrieën, waaronder energieopwekking, verwarming, transport en landbouw. Het is een belangrijk onderdeel van aardgas en wordt gebruikt als brandstof om huizen te verwarmen en voedsel te koken. In de energieopwekkingsindustrie wordt methaan verbrand om stoom te produceren, die turbines aandrijft om elektriciteit te produceren. In de transportsector wordt het gebruikt als brandstof voor voertuigen en scheepvaart. Methaan wordt ook gebruikt als grondstof bij de productie van chemicaliën, zoals methanol en waterstof, en wordt in de koelindustrie gebruikt als koelgas. Daarnaast wordt methaan in de landbouw gebruikt als brandstof voor irrigatiepompen en in de veehouderij om de stallen te verwarmen, maar ook als energiebron voor veevoer.
