Koolstofdisulfide is een vluchtige chemische verbinding die wordt gevormd door koolstof en zwavel te combineren. Het wordt gebruikt in industriële processen, oplosmiddelen en de productie van rayonvezels.
| IUPAC-naam | Koolstofdisulfide |
| Moleculaire formule | CS2 |
| CAS-nummer | 75-15-0 |
| Synoniemen | Koolstofdisulfide, dithiocarb, koolstofdisulfide |
| InChi | InChI=1S/CS2/c2-1-3 |
Eigenschappen van koolstofdisulfide
Koolstofdisulfide-formule
De chemische formule voor koolstofdisulfide is CS2. Het bestaat uit één koolstofatoom en twee zwavelatomen, aan elkaar gebonden in een lineaire opstelling. Deze eenvoudige formule is essentieel voor het begrijpen van de basissamenstelling van de verbinding.
Molaire massa koolstofdisulfide
De molaire massa van koolstofdisulfide is ongeveer 76,14 g/mol. Om dit te berekenen, tellen we de atoommassa’s van één koolstofatoom (12,01 g/mol) en twee zwavelatomen (elk 32,06 g/mol) op. Het kennen van de molaire massa helpt bij verschillende chemische berekeningen.
Kookpunt van koolstofdisulfide
Koolstofdisulfide heeft een relatief laag kookpunt van ongeveer 46,3°C (115,3°F). Deze eigenschap maakt het vluchtig en gemakkelijk verdampbaar. Het lage kookpunt is belangrijk in industriële processen en toepassingen waarbij snelle verdamping vereist is.
Smeltpunt van koolstofdisulfide
Het smeltpunt van koolstofdisulfide is ongeveer -110,8°C (-187,4°F). Het blijft in vaste toestand bij temperaturen onder dit punt en verandert bij verhitting in vloeibare toestand. Het begrijpen van het smeltpunt is cruciaal voor hantering en opslag.
Dichtheid van koolstofdisulfide g/ml
De dichtheid van koolstofdisulfide is ongeveer 1,26 g/ml bij kamertemperatuur. Deze waarde betekent de massa per volume-eenheid. Omdat het een hogere dichtheid heeft dan water, zal het zinken als het wordt gemengd en de dichtheid ervan zal de oplosbaarheid in verschillende oplosmiddelen beïnvloeden.
Koolstofdisulfide Molecuulgewicht
Het molecuulgewicht van koolstofdisulfide is ongeveer 76,14 g/mol, berekend op basis van de chemische formule. Deze waarde speelt een essentiële rol bij de stoichiometrie en bij het bepalen van de hoeveelheid verbinding in chemische reacties.
Structuur van koolstofdisulfide
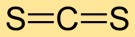
Koolstofdisulfide heeft een lineaire moleculaire structuur, met het koolstofatoom in het midden en zwavelatomen aan weerszijden. Deze eenvoudige opstelling is cruciaal voor het begrijpen van het chemische gedrag en de interacties met andere stoffen.
Oplosbaarheid van koolstofdisulfide
Koolstofdisulfide is slecht oplosbaar in water, met slechts ongeveer 0,2 g per 100 ml water bij kamertemperatuur. Het is echter zeer oplosbaar in organische oplosmiddelen zoals benzeen en ethanol. Dit oplosbaarheidsgedrag is essentieel voor diverse toepassingen in de chemie en industrie.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.26 |
| Kleur | Kleurloos |
| Geur | Scherp en zoet aroma |
| Molaire massa | 76,14 g/mol |
| Dikte | 1,26 g/ml |
| Fusie punt | -110,8°C (-187,4°F) |
| Kookpunt | 46,3°C (115,3°F) |
| Flitspunt | -30°C (-22°F) |
| oplosbaarheid in water | 0,2 g/100 ml (20°C) |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen en ethanol |
| Dampdruk | 318 mmHg (20°C) |
| Dampdichtheid | 2,62 (lucht = 1) |
| pKa | ~ -2 |
| pH | Neutraal (pH 7) |
Veiligheid en gevaren van koolstofdisulfide
Koolstofdisulfide brengt aanzienlijke veiligheidsrisico’s met zich mee. Het is licht ontvlambaar en de dampen ervan kunnen explosieve mengsels in de lucht vormen. Langdurige blootstelling kan duizeligheid, hoofdpijn en zelfs bewustzijnsverlies veroorzaken. Het is ook schadelijk voor het waterleven en het milieu. Voldoende ventilatie, persoonlijke beschermingsmiddelen en brandwerende opslag zijn essentieel om risico’s te minimaliseren. Vermijd contact met huid en ogen, aangezien dit irritatie en schade kan veroorzaken. De behandeling moet plaatsvinden in goed gecontroleerde omgevingen en lekkages moeten snel worden ingedamd. Het begrijpen en opvolgen van veiligheidsinstructies is essentieel om ongelukken te voorkomen en een veilige werkomgeving te garanderen bij het omgaan met koolstofdisulfide.
| Gevarensymbolen | Ontvlambaar, schadelijk |
| Beveiligingsbeschrijving | Licht ontvlambare vloeistof en damp. Schadelijk bij inademing of inslikken. Veroorzaakt huid- en oogirritatie. |
| VN-identificatienummers | VN1131 |
| HS-code | 2813.10.1000 |
| Gevarenklasse | 3 (Ontvlambare vloeistoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Matige toxiciteit |
Methoden voor de synthese van koolstofdisulfide
Verschillende actieve methoden maken de synthese van koolstofdisulfide mogelijk.
Een gebruikelijke methode is het laten reageren van zwavel met methaan of aardgas bij hoge temperaturen, waarbij CS2 als product ontstaat.
Een andere benadering is om zwaveldamp te laten reageren met hete steenkool. Bovendien kan de combinatie van koolmonoxide en zwaveldamp over een katalysator ook koolstofdisulfide produceren.
Bovendien kan directe synthese van CS2 plaatsvinden wanneer koolstof reageert met zwaveldamp bij verhoogde temperaturen. In het laboratorium gebruiken scheikundigen de reactie tussen kaliumxanthaat en zwavelzuur voor de kleinschalige productie van koolstofdisulfide.
Elke methode vereist passende veiligheidsmaatregelen vanwege de licht ontvlambare en giftige aard van koolstofdisulfide. De veelzijdigheid van deze synthesemethoden maakt verschillende industriële toepassingen mogelijk, waaronder het gebruik ervan als oplosmiddel, als grondstof in chemische processen en bij de vervaardiging van rayonvezels.
Gebruik van koolstofdisulfide
Koolstofdisulfide vindt verschillende toepassingen vanwege zijn veelzijdige eigenschappen. Hier zijn enkele toepassingen:
- Onderzoek en laboratoriumtoepassingen: Laboratoria gebruiken koolstofdisulfide als reagens voor verschillende chemische reacties, waaronder de synthese van organometaalverbindingen.
- Extractie van essentiële oliën: Koolstofdisulfide vindt toepassing bij de extractie van essentiële oliën uit planten, waardoor de scheiding van de gewenste aromatische verbindingen wordt vergemakkelijkt.
- Olie-extractie: Industrieën gebruiken koolstofdisulfide om oliën uit zaden en groenten te extraheren vanwege de oplosbaarheid en het lage kookpunt.
- Productie van rayonvezels: Koolstofdisulfide speelt een cruciale rol bij de productie van rayonvezels omdat het helpt bij het oplossen van cellulose, die fabrikanten vervolgens extruderen om synthetische vezels te vormen die in textiel worden gebruikt.
- Industriële toepassingen: Koolstofdisulfide draagt bij aan de productie van pesticiden, ontsmettingsmiddelen en rubberchemicaliën. Bovendien fungeert het als katalysator bij de productie van zwavelzuur en tetrachloorkoolstof.
- Oplosmiddel: Koolstofdisulfide dient als oplosmiddel voor een verscheidenheid aan stoffen, waaronder oliën, vetten, rubber, harsen en zwavel. Als gevolg hiervan wordt het vaak gebruikt bij de productie van producten op basis van cellulose.
- Chemische processen: Het dient als grondstof bij de synthese van organische verbindingen zoals tetrachloorkoolstof, thiocarbamaten en dithiocarbamaten. Deze verbindingen vinden toepassingen in de landbouw- en farmaceutische industrie.
- Rubbervulkanisatie: Koolstofdisulfide neemt deel aan het vulkanisatieproces van rubber, waardoor de sterkte, elasticiteit en slijtvastheid worden verbeterd.
Deze uiteenlopende toepassingen benadrukken het belang van koolstofdisulfide in meerdere industrieën, variërend van textiel en landbouw tot onderzoek en productie.
Vragen:
Vraag: Welke van de volgende moleculen is polair? A. ammoniak B. octaan c. water d. koolstofdisulfide
A: a, Water (H2O) is polair vanwege de gebogen moleculaire vorm en de ongelijke verdeling van elektronen.
Vraag: Wat is de hoek tussen de koolstof-zwavelbindingen in het koolstofdisulfide (CS2) molecuul?
A: De hoek tussen de koolstof-zwavelbindingen in CS2 is 180 graden en vormt een lineaire geometrie.
Vraag: Hoeveel atomen zitten er in totaal in 1 mol koolstofdisulfide?
A: Eén mol koolstofdisulfide bevat 6,02 x 10^23 moleculen, en elk molecuul heeft 3 atomen (1 koolstof en 2 zwavel).
Vraag: Welke van deze elementen zou volgens u oplosbaar zijn in het niet-polaire oplosmiddel, koolstofdisulfide, CS2?
A: Niet-polaire stoffen zoals octaan (b) moeten oplosbaar zijn in koolstofdisulfide (CS2).
Vraag: Wat is het normale kookpunt van koolstofdisulfide?
A: Het normale kookpunt van koolstofdisulfide is ongeveer 46,3°C (115,3°F).
Vraag: Is koolstofdisulfide polair of niet-polair?
A: Koolstofdisulfide (CS2) is een niet-polair molecuul vanwege zijn lineaire vorm en gelijke verdeling van elektronen.
Vraag: Wat is de formule voor koolstofdisulfide?
A: De formule voor koolstofdisulfide is CS2.
Vraag: Wat is koolstofdisulfide?
A: Koolstofdisulfide (CS2) is een vluchtige chemische verbinding bestaande uit één koolstofatoom en twee zwavelatomen, die in verschillende industriële toepassingen wordt gebruikt.
Vraag: Hoe belangrijk is het feit dat koolstofdisulfide een grotere dichtheid heeft dan water?
A: De hogere dichtheid van koolstofdisulfide vergeleken met water betekent dat het niet gemakkelijk zal mengen en bij combinatie afzonderlijke lagen zal vormen.
Vraag: Hoe kunnen mensen koolstofdisulfide tegenkomen?
A: Mensen kunnen in contact komen met koolstofdisulfide via industriële processen, chemische toepassingen of het hanteren van bepaalde producten.
Vraag: Wat gebeurt er als u koolstofdisulfide binnenkrijgt?
A: Het innemen van koolstofdisulfide kan gezondheidsproblemen veroorzaken, waaronder misselijkheid, hoofdpijn en effecten op het zenuwstelsel, waardoor het gevaarlijk wordt voor de menselijke gezondheid.
Vraag: Is koolstofdisulfide dichter dan water?
A: Ja, koolstofdisulfide heeft een grotere dichtheid dan water, met een dichtheid van ongeveer 1,26 g/ml vergeleken met de dichtheid van water van 1 g/ml.
