Kaliumthiosulfaat (K2S2O3) is een chemische verbinding die in de fotografie wordt gebruikt als reductiemiddel en om chloor in zwembaden te neutraliseren. Het heeft een wit kristallijn uiterlijk en is oplosbaar in water.
| IUPAC-naam | Kaliumthiosulfaat |
| Moleculaire formule | K2S2O3 |
| CAS-nummer | 10294-66-3 |
| Synoniemen | Kaliumhyposulfiet, kaliumthiosulfaat, kaliumthiosulfaatpentahydraat, kaliumthiosulfaatpentahydraat, kaliumzwavelothioaat, kaliumzwavelothiozuur |
| InChi | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Eigenschappen van kaliumthiosulfaat
Kaliumthiosulfaatformule
De chemische formule voor kaliumthiosulfaat (K2S2O3) geeft het aantal en het type atomen aan dat in de verbinding aanwezig is. De formule bestaat uit twee kaliumatomen, twee zwavelatomen en drie zuurstofatomen. Kaliumatomen hebben een positieve lading, terwijl zwavel- en zuurstofatomen een negatieve lading hebben.
Kaliumthiosulfaat Molaire massa
De molaire massa van K2S2O3 is 190,33 g/mol. Molaire massa is de massa van één mol van een stof en wordt berekend door de atoommassa’s van alle atomen in de chemische formule bij elkaar op te tellen. In het geval van K2S2O3 bestaat de formule uit twee kaliumatomen, twee zwavelatomen en drie zuurstofatomen.
Kookpunt van kaliumthiosulfaat
K2S2O3 heeft geen kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Ontleding vindt plaats wanneer de temperatuur ongeveer 100°C bereikt en er zwaveldioxide vrijkomt. Daarom wordt de verbinding over het algemeen niet gebruikt bij toepassingen bij hoge temperaturen.
Kaliumthiosulfaat Smeltpunt
Het smeltpunt van K2S2O3 is 48,3°C. Deze temperatuur is relatief laag in vergelijking met andere chemische verbindingen. Bij verhitting tot deze temperatuur wordt de vaste stof K2S2O3 vloeibaar.
Dichtheid van kaliumthiosulfaat g/ml
De dichtheid van K2S2O3 is 1,667 g/ml. Dichtheid is een maatstaf voor de hoeveelheid massa die zich in een bepaald volume bevindt. Deze waarde betekent dat één milliliter K2S2O3 een massa heeft van 1,667 gram.
Kaliumthiosulfaat Molecuulgewicht
Het molecuulgewicht van K2S2O3 is 190,33 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in de verbinding. Het wordt vaak gebruikt om mollen en grammen van een stof om te rekenen.
Structuur van kaliumthiosulfaat
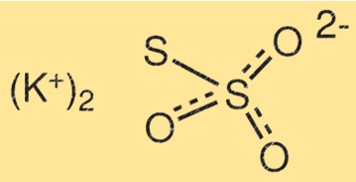
De structuur van K2S2O3 bestaat uit twee kaliumatomen, twee zwavelatomen en drie zuurstofatomen. De zwavelatomen zijn met elkaar verbonden door een dubbele binding, terwijl het andere zwavelatoom aan een van de zuurstofatomen is gebonden. De kaliumatomen zijn gebonden aan de overige zuurstofatomen.
Oplosbaarheid van kaliumthiosulfaat
K2S2O3 is zeer oplosbaar in water, met een oplosbaarheid van 432 g/L bij 20°C. Dit maakt het een effectief middel voor waterbehandeling en als fotografisch fixeermiddel. Het is echter niet oplosbaar in organische oplosmiddelen zoals ethanol of aceton.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1.667 |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 190,33 g/mol |
| Dikte | 1.667 g/ml |
| Fusie punt | 48,3°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar (432 g/L bij 20°C) |
| Oplosbaarheid | Onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | 6,0 – 9,0 (5% waterige oplossing) |
Veiligheid en gevaren van kaliumthiosulfaat
K2S2O3 wordt over het algemeen als veilig beschouwd om te hanteren en te gebruiken als de juiste voorzorgsmaatregelen worden genomen. Het is echter belangrijk om op de hoogte te zijn van enkele potentiële gevaren die aan deze stof zijn verbonden. Blootstelling aan K2S2O3-stof of -damp kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Het innemen van de stof kan ook misselijkheid, braken en diarree veroorzaken. Bovendien kan contact met de verbinding bij sommige mensen dermatitis of huidsensibilisatie veroorzaken. Zoals bij elke chemische stof is het belangrijk om de juiste veiligheidsprotocollen te volgen bij het hanteren van K2S2O3 om blootstelling te voorkomen en het risico op ongelukken te verminderen.
| Gevarensymbolen | XI |
| Beveiligingsbeschrijving | S22 – Stof niet inademen. S24/25 – Vermijd contact met huid en ogen. S37/39 – Draag geschikte handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | VN 3077 |
| HS-code | 2832.10.00 |
| Gevarenklasse | 9 – Diverse gevaarlijke materialen |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat): 2.500 mg/kg |
Methoden voor de synthese van kaliumthiosulfaat
K2S2O3 kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van zwavel met kaliumsulfiet in aanwezigheid van een alkalimetaalhydroxide.
Een andere methode omvat de reactie van kaliumhydroxide met zwavel en zwaveldioxidegas. Deze reactie produceert K2S2O3 en kaliumsulfaat als bijproducten.
Een alternatieve synthesemethode omvat de reactie van kaliumsulfiet met natriumthiosulfaat in een waterige oplossing. Het resulterende neerslag kan worden gefiltreerd en gewassen om zuiver K2S2O3 te verkrijgen.
Om K2S2O3 in het laboratorium te bereiden, kan men kaliumhydroxide met zwavel laten reageren en vervolgens zwaveldioxidegas aan het mengsel toevoegen. Het resulterende product is een witte kristallijne vaste stof die verder kan worden gezuiverd door herkristallisatie.
Gebruik van kaliumthiosulfaat
K2S2O3 heeft verschillende belangrijke toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Fotografie: Kaliumthiosulfaat wordt gebruikt als fixeermiddel bij fotografische verwerking om ongebruikte zilverhalogeniden te verwijderen en vervaging van het beeld te voorkomen.
- Landbouw: Kaliumthiosulfaat wordt gebruikt als meststof om planten te voorzien van zwavel en kalium, belangrijke voedingsstoffen voor groei en ontwikkeling.
- Waterbehandeling: Kaliumthiosulfaat wordt gebruikt om chloor uit zwembad- en spawater te verwijderen, en om de effecten van chloor bij de behandeling van industrieel afvalwater te neutraliseren.
- Analytische chemie: Kaliumthiosulfaat wordt in de analytische chemie gebruikt als reductiemiddel om de concentratie van jodium en andere oxidatiemiddelen te bepalen.
- Medische behandelingen: Kaliumthiosulfaat is gebruikt bij sommige medische behandelingen, zoals de behandeling van cyanidevergiftiging.
- Industriële toepassingen: Kaliumthiosulfaat wordt gebruikt in verschillende industriële toepassingen, zoals galvaniseren, leerlooien en olie-extractie.
Vragen:
Vraag: Hoe bepaal je of iets een kaliumthiosulfaat-reductiemiddel is?
A: K2S2O3 is een reductiemiddel omdat het elektronen kan doneren aan andere moleculen of ionen, waardoor hun oxidatietoestand wordt verminderd.
Vraag: Wat maakt kaliumthiosulfaat tot een reductiemiddel?
A: K2S2O3 heeft een zwavelatoom met een lagere oxidatietoestand dan sulfaat, waardoor het elektronen aan andere moleculen of ionen kan doneren en als reductiemiddel kan werken.
Vraag: Verbrandt kaliumthiosulfaat groene groenten?
A: Nee, K2S2O3 verbrandt geen groen. Het is een witte kristallijne vaste stof en vertoont geen groene kleur.
Vraag: Wat is de molaire oplosbaarheid van AgCl in 1,0 M K2S2O3?
A: De molaire oplosbaarheid van AgCl in 1,0 M K2S2O3 hangt af van verschillende factoren, zoals temperatuur en ionsterkte. Zonder aanvullende informatie kan geen exacte waarde worden bepaald.
Vraag: Wat is het ladings- of oxidatiegetal van K in 2 (K2S2O3)?
A: Het ladings- of oxidatiegetal van K in 2 (K2S2O3) is +1.
Vraag: Wat is de oxidatietoestand van S in K2S2O3?
A: De oxidatietoestand van S in K2S2O3 is +2.
Vraag: Hoeveel moleculen zitten er in 4 mol K2S2O3?
A: Er zijn ongeveer 4 x 6,022 x 10^23 moleculen K2S2O3 in 4 mol K2S2O3, wat overeenkomt met 2,409 x 10^24 moleculen.
Vraag: Hoeveel kost 4 mol K2S2O3?
A: De massa van 4 mol K2S2O3 kan worden berekend door de molaire massa van K2S2O3 (190,31 g/mol) te vermenigvuldigen met 4, wat gelijk is aan 761,24 gram. Daarom is 4 mol K2S2O3 gelijk aan 761,24 gram.
