Kaliumperoxide (K2O2) is een verbinding gemaakt van kalium en zuurstof. Het wordt vaak gebruikt als sterk oxidatiemiddel in industrieën en laboratoria om verschillende chemische reacties te vergemakkelijken.
| IUPAC-naam | Kaliumperoxyoxydanide |
| Moleculaire formule | K2O2 |
| CAS-nummer | 17014-71-0 |
| Synoniemen | Kaliumsuperoxide; Dikaliumdioxide; Kaliumdioxide; Perkaliumoxide |
| InChi | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Eigenschappen van kaliumperoxide
Kaliumperoxide-formule
De chemische formule voor kaliumperoxide is K2O2. Deze formule vertegenwoordigt het aantal en het type atomen dat in het molecuul aanwezig is. De formule is belangrijk voor het identificeren van de stof en het begrijpen van de chemische eigenschappen ervan.
Kaliumperoxide molaire massa
De molaire massa van K2O2 bedraagt 110,2 g/mol. Dit betekent dat één mol K2O2 110,2 gram weegt. Molaire massa is een belangrijke eigenschap van een stof, omdat je hiermee de hoeveelheid van een stof in een bepaalde massa of volume kunt berekenen.
Kookpunt van kaliumperoxide
K2O2 heeft geen specifiek kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij hoge temperaturen valt K2O2 uiteen in kaliumoxide en zuurstofgas. Daarom wordt het over het algemeen niet gebruikt bij toepassingen bij hoge temperaturen.
Smeltpunt van kaliumperoxide
Het smeltpunt van K2O2 is 655°C. Dit hoge smeltpunt maakt het een geschikt oxidatiemiddel bij reacties bij hoge temperaturen. Het is echter belangrijk op te merken dat het kan ontleden voordat het zijn smeltpunt bereikt als het wordt blootgesteld aan hoge temperaturen of vochtigheid.
Dichtheid van kaliumperoxide g/ml
De dichtheid van K2O2 is 2,08 g/ml. Deze hoge dichtheid maakt het tot een dichte vaste stof die in water zinkt. De dichtheid van K2O2 is ook belangrijk bij het bepalen van de oplosbaarheid ervan in verschillende oplosmiddelen.
Kaliumperoxide Molecuulgewicht
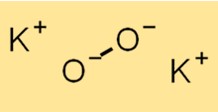
Het molecuulgewicht van K2O2 bedraagt 110,2 g/mol. Deze waarde is de som van de atoomgewichten van alle atomen die in het molecuul aanwezig zijn. Het molecuulgewicht is een belangrijke eigenschap die wordt gebruikt om verschillende eigenschappen van een stof te berekenen, waaronder de molaire massa en dichtheid.
Structuur van kaliumperoxide
De structuur van K2O2 bestaat uit een K+ kation en een O2^2-anion. Het O2^2-anion bestaat uit twee zuurstofatomen die covalent aan elkaar gebonden zijn. De structuur van K2O2 is essentieel voor het begrijpen van de chemische eigenschappen en reactiviteit ervan.
| Verschijning | Witte tot lichtgele vaste stof |
| Soortelijk gewicht | 2.08 |
| Kleur | Wit tot lichtgeel |
| Geur | Geurloos |
| Molaire massa | 110,2 g/mol |
| Dikte | 2,08 g/ml |
| Fusie punt | 655°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert met water |
| Oplosbaarheid | Onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Kaliumperoxide Veiligheid en gevaren
K2O2 brengt verschillende veiligheidsrisico’s met zich mee vanwege de sterke oxiderende eigenschappen. Het kan krachtig reageren met water of vocht, waarbij zuurstofgas vrijkomt en warmte ontstaat. Deze reactie kan mogelijk brand of explosie veroorzaken als er niet op de juiste manier mee wordt omgegaan. Bovendien kan het bij contact huid- en oogirritatie veroorzaken, en het inademen van het stof kan ademhalingsproblemen veroorzaken. Het is belangrijk om voorzichtig met K2O2 om te gaan, de juiste persoonlijke beschermingsmiddelen te dragen en het op een koele, droge plaats op te slaan, uit de buurt van warmtebronnen en onverenigbare materialen. In geval van accidentele blootstelling dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Niet blootstellen aan water. Draag beschermende handschoenen en oog-/gezichtsbescherming. Bewaren op een koele, droge plaats, uit de buurt van warmtebronnen en onverenigbare materialen. |
| VN-identificatienummers | UN1504 |
| HS-code | 2829.90.90 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Het inademen van stof kan ademhalingsproblemen veroorzaken. |
Synthesemethoden voor kaliumperoxide
Er zijn verschillende methoden voor het synthetiseren van K2O2, waaronder de reactie van kaliumhydroxide met waterstofperoxide , de reactie van kaliumhydroxide met bariumperoxide en de thermische ontleding van kaliumsuperoxide.
De eerste methode bestaat uit het langzaam toevoegen van kaliumhydroxide aan een waterstofperoxide -oplossing terwijl je roert totdat er een wit neerslag van K2O2 ontstaat. Het proces omvat het filteren van het mengsel en het wassen van de vaste stof met koud water om onzuiverheden te verwijderen.
Bij de tweede methode roer je een suspensie van bariumperoxide terwijl je een oplossing van kaliumhydroxide toevoegt. Filtreer het mengsel en damp het filtraat droog. Verwarm vervolgens de resulterende vaste stof tot een hoge temperatuur om eventueel achtergebleven bariumperoxide te ontleden en K2O2 te vormen.
De derde methode omvat het verwarmen van kaliumsuperoxide tot een hoge temperatuur, waardoor het uiteenvalt in K2O2 en zuurstofgas.
Gebruik van kaliumperoxide
K2O2 heeft verschillende toepassingen in verschillende industrieën vanwege zijn oxiderende eigenschappen. Enkele van de toepassingen zijn onder meer:
- Bleekmiddel: Gebruikt als bleekmiddel voor textiel- en papierproducten, maar ook voor producten voor het bleken van haar en tanden.
- Zuurstofbron: Gebruikt als zuurstofbron in gesloten systemen, zoals in onderzeeërs, waar het zuurstof kan vrijgeven wanneer het met water wordt gemengd.
- Polymerisatie: Gebruikt bij de polymerisatie van bepaalde monomeren om polymeren te produceren, zoals bij de synthese van polystyreen.
- Bodemsanering: Gebruikt voor bodemsanering om organische verontreinigingen, zoals olievlekken, te verwijderen.
- Analytische chemie: Gebruikt in de analytische chemie als oxidatiemiddel om de aanwezigheid van bepaalde verbindingen te bepalen.
- Raketbrandstof: wordt gebruikt als oxidatiemiddel in raketbrandstof vanwege het vermogen om zuurstof vrij te geven.
- Chemische synthese: Gebruikt bij de synthese van verschillende organische en anorganische verbindingen, zoals de synthese van kaliumpermanganaat.
Vragen:
Vraag: Wat is beter: waterstofperoxide of kaliumhydroxide?
A: Het hangt af van het beoogde gebruik. Waterstofperoxide is een krachtig oxidatiemiddel en wordt vaak gebruikt als ontsmettingsmiddel, bleekmiddel en haar- en tandbleekmiddel. Kaliumhydroxide daarentegen is een sterke base en wordt veel gebruikt bij de productie van zepen en wasmiddelen, maar ook bij de productie van biodiesel uit plantaardige oliën.
Vraag: Wat zijn de chemische formules voor kaliumsuperoxide, kaliumperoxide en kaliumoxide?
A: De chemische formules zijn K2O2 voor kaliumsuperoxide, K2O2 voor kaliumperoxide en K2O voor kaliumoxide.
Vraag: Wat ontstaat er als waterstofperoxide reageert met kaliumjodide en jodaat?
A: Wanneer waterstofperoxide reageert met kaliumjodide en jodaat, wordt jodium geproduceerd volgens de volgende reactie: H2O2 + KI + KIO3 → I2 + K2O + H2O.
Vraag: Wat is het oxidatiegetal van het zuurstofatoom in K2O2?
A: Het oxidatiegetal van het zuurstofatoom in K2O2 is -1.
Vraag: Wat is het oxidatiegetal van K in K2O2?
A: Het oxidatiegetal van K in K2O2 is +1.
