Kaliumnitriet (KNO2) is een chemische verbinding die vaak wordt gebruikt als conserveermiddel voor levensmiddelen. Het is bekend dat het de groei van bacteriën remt en bederf van vlees en ander voedsel voorkomt.
| IUPAC-naam | Kaliumnitriet |
| Moleculaire formule | KNO2 |
| CAS-nummer | 7758-09-0 |
| Synoniemen | Salpeterigzuur, kaliumzout; salpeter(III); salpeterigzuur, verbinding. met kaliumzout (1:1); E249 |
| InChi | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Eigenschappen van kaliumnitriet
Kaliumnitrietformule
De chemische formule voor kaliumnitriet is KNO2. Het vertegenwoordigt de samenstelling van de verbinding in termen van de samenstellende atomen. De formule voor kaliumnitriet wordt gebruikt om de molmassa en het molecuulgewicht te berekenen.
Kaliumnitriet Molaire massa
De molaire massa van KNO2 is 85,103 g/mol. Het wordt afgeleid uit de som van de atoommassa’s van kalium (39,10 g/mol), stikstof (14,01 g/mol) en twee zuurstofatomen (2 x 16,00 g/mol). De molaire massa van KNO2 is essentieel om te bepalen hoeveel van de stof aanwezig is in een bepaalde massa of volume.
Kookpunt van kaliumnitriet
Het kookpunt van KNO2 is 320°C (608°F). Bij deze temperatuur verandert de verbinding van een vloeibare fase naar een gasfase. Het kookpunt van KNO2 is afhankelijk van verschillende factoren, zoals druk en zuiverheid.
Kaliumnitriet Smeltpunt
Het smeltpunt van KNO2 is 441°C (826°F). Bij deze temperatuur gaat de vaste verbinding over in de vloeibare fase. Het smeltpunt van KNO2 is een cruciale parameter bij het bepalen van de geschiktheid ervan voor verschillende toepassingen, zoals het bewaren van voedsel en medicijnen.
Dichtheid van kaliumnitriet g/ml
De dichtheid van KNO2 is 1,915 g/ml bij kamertemperatuur. De dichtheid van een stof wordt gedefinieerd als de massa van de stof per volume-eenheid. De dichtheid van KNO2 speelt een belangrijke rol bij het bepalen van de fysische eigenschappen ervan, zoals de oplosbaarheid en chemische reactiviteit.
Kaliumnitriet Molecuulgewicht
Het molecuulgewicht van KNO2 is 85,103 g/mol. Het is een cruciale parameter voor het bepalen van de stoichiometrie van een reactie waarbij KNO2 betrokken is. Het molecuulgewicht van KNO2 wordt ook gebruikt om de fysische en chemische eigenschappen ervan te bepalen.
Structuur van kaliumnitriet
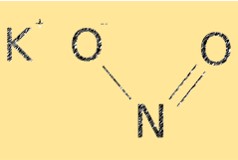
KNO2 heeft de molecuulformule KNO2. Het heeft een ionische structuur, met kaliumkationen (K+) en nitrietanionen (NO2-). Het nitrietion heeft een gebogen moleculaire geometrie, met een bindingshoek van ongeveer 115°. De structuur van KNO2 is essentieel bij het bepalen van de chemische eigenschappen ervan, zoals de oplosbaarheid en reactiviteit.
Oplosbaarheid van kaliumnitriet
KNO2 is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 710 g/L bij 20°C. De oplosbaarheid van KNO2 is afhankelijk van verschillende factoren zoals temperatuur, druk en de aanwezigheid van andere stoffen. De oplosbaarheid van KNO2 is een cruciale parameter bij het bepalen van de geschiktheid ervan voor verschillende toepassingen, zoals het bewaren van voedsel en medicijnen.
| Verschijning | Witte tot geelachtige kristallijne vaste stof |
| Soortelijk gewicht | 1.915 |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 85,103 g/mol |
| Dikte | 1,915 g/ml |
| Fusie punt | 441°C (826°F) |
| Kookpunt | 320°C (608°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar (710 g/L bij 20°C) |
| Oplosbaarheid | Oplosbaar in ethanol, enigszins oplosbaar in ammoniak |
| Dampdruk | 0,0038 mmHg bij 25°C |
| Dampdichtheid | 2,96 (lucht = 1) |
| pKa | 3.35 |
| pH | 5-8 (5% oplossing) |
Kaliumnitriet Veiligheid en gevaren
KNO2 kan gevaarlijk zijn als er verkeerd mee wordt omgegaan. Het is schadelijk bij inslikken of inademen en kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Langdurige of herhaalde blootstelling aan KNO2 kan methemoglobinemie veroorzaken, een aandoening die het vermogen van het bloed om zuurstof te vervoeren vermindert. KNO2 is tevens een sterk oxidatiemiddel en kan heftig reageren met brandbare materialen, waardoor brand of explosies kunnen ontstaan. Bij het hanteren van KNO2 moeten de juiste veiligheidsmaatregelen, zoals het gebruik van beschermende uitrusting, voldoende ventilatie en veilige opslag, worden gevolgd. Indien ingeslikt of ingeademd, dient u onmiddellijk medische hulp te zoeken.
| Gevarensymbolen | Xn |
| Beveiligingsbeschrijving | S22, S24/25 |
| VN-identificatienummers | VN 1488 |
| HS-code | 2834.29.10 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | III |
| Toxiciteit | Schadelijk bij inslikken of inademen, kan methemoglobinemie veroorzaken |
Synthesemethoden voor kaliumnitriet
Kaliumhydroxide (KOH) reageert met salpeterigzuur (HNO2) om KNO2 te synthetiseren. De reactie produceert KNO2 en water (H2O) als bijproducten. De industrie gebruikt deze methode vaak om grote hoeveelheden KNO2 te vervaardigen.
De reactievergelijking is:
2 KOH + HNO2 → KNO2 + 2 H2O
Een andere methode om KNO2 te synthetiseren is door kaliumcarbonaat (K2CO3) te laten reageren met stikstofmonoxide (NO). Bij de reactie ontstaan KNO2, kooldioxide (CO2) en stikstof (N2) als bijproducten. Het verkrijgen van stikstofmonoxide is moeilijk en duur, waardoor deze methode minder vaak wordt gebruikt.
De reactievergelijking is:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 kan worden verkregen door KNO3 te oxideren met een reductiemiddel zoals SO2 of FeSO4.
De reactie produceert KNO2, water en de gereduceerde vorm van het reductiemiddel als bijproducten. Wetenschappers gebruiken deze methode minder vaak en reserveren deze doorgaans voor kleinschalige laboratoriumsyntheses.
De vergelijking voor de reactie met zwaveldioxide is:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Gebruik van kaliumnitriet
KNO2 heeft vanwege zijn chemische eigenschappen verschillende industriële en laboratoriumtoepassingen. Enkele veel voorkomende toepassingen van KNO2 zijn:
- Voedselconservering: Gebruikt als conserveermiddel in gezouten vlees om de groei van schadelijke bacteriën te voorkomen en de houdbaarheid ervan te verlengen.
- Chemische industrie: Gebruikt als tussenproduct bij de productie van verschillende chemicaliën, zoals salpeterigzuur, diazoniumverbindingen en organische nitrieten.
- Landbouw: Gebruikt als meststof en bodemverbeteraar vanwege de hoge wateroplosbaarheid en het vermogen om stikstof vrij te geven.
- Laboratoriumreagens: Wordt gebruikt als reagens in verschillende laboratoriumtoepassingen, zoals de detectie van primaire aminen en de bereiding van diazoniumzouten.
- Medicinaal gebruik: Wordt gebruikt bij de behandeling van cyanidevergiftiging omdat het reageert met cyanide-ionen en zo niet-giftig cyaanmethemoglobine vormt.
- Fotografie: Gebruikt als additief in fotografische ontwikkelaars om de kwaliteit en helderheid van ontwikkelde afbeeldingen te verbeteren.
- Glasindustrie: Gebruikt in de glasindustrie als bleekmiddel om ongewenste kleurstoffen uit glasproducten te verwijderen.
Vragen:
Wat is kaliumnitriet?
A: KNO2 is een anorganische verbinding die vaak wordt gebruikt in verschillende industriële en laboratoriumtoepassingen.
Vraag: Wat is de formule voor kaliumnitriet?
A: De chemische formule voor kaliumnitriet is KNO2.
Vraag: Welk zout ontstaat wanneer NH4OH reageert met HNO3? KNO2, NaNO3, NH4NO3 of NH4NO2?
A: Wanneer NH4OH reageert met HNO3, is het geproduceerde zout NH4NO3.
Vraag: Is KNO2 een zuur of een base?
A: KNO2 is een basische verbinding.
Vraag: Wat is de naam van de verbinding met de formule KNO2?
A: De naam van de verbinding met de formule KNO2 is kaliumnitriet.
Vraag: Is KNO2 een zwakke basis?
A: KNO2 wordt als een zwakke base beschouwd.
Vraag: Is KNO2 zuur of basisch?
A: KNO2 is basisch van aard en kan werken als een mild reductiemiddel.
