Kaliumnitraat (KNO3) is een wit kristallijn zout dat vaak wordt gebruikt in meststoffen, voedselconservering en vuurwerk. Het is ook een belangrijk ingrediënt in sommige tandpasta’s voor gevoelige tanden.
| IUPAC-naam | Kaliumnitraat |
| Moleculaire formule | KNO3 |
| CAS-nummer | 7757-79-1 |
| Synoniemen | salpeter; nitraat van potas; salpeter; salpeter; E252; Chinese salpeter; salpeterzuur, kaliumzout; Nitra’s van Kalii |
| InChi | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Eigenschappen van kaliumnitraat
Kaliumnitraatformule
De chemische formule voor kaliumnitraat is KNO3. Deze formule laat zien dat de verbinding bestaat uit één kaliumion, één nitraation en drie zuurstofionen. De formule is nuttig voor het berekenen van de hoeveelheid kaliumnitraat die nodig is voor een reactie, en voor het identificeren van de elementen en ionen die in de verbinding aanwezig zijn.
Kaliumnitraat Molaire massa
KNO3 heeft een molaire massa van 101,1 g/mol. Molaire massa is de massa van één mol van een stof en wordt berekend door de atoommassa’s van alle atomen in de verbinding bij elkaar op te tellen. In het geval van KNO3 wordt de molaire massa berekend door de atoommassa van één kaliumatoom, één stikstofatoom en drie zuurstofatomen op te tellen. Deze waarde is nuttig voor het bepalen van de hoeveelheid KNO3 die nodig is bij een reactie en voor het berekenen van andere eigenschappen zoals concentratie.
Kookpunt van kaliumnitraat
KNO3 heeft een relatief hoog kookpunt van 1,336 °C (2,437 °F). Dit betekent dat het veel energie kost om de bindingen tussen de atomen van de verbinding te verbreken en deze van een vloeistof in een gas om te zetten. Deze eigenschap maakt KNO3 nuttig in toepassingen die reacties bij hoge temperaturen vereisen, zoals bij de vervaardiging van vuurwerk.
Smeltpunt van kaliumnitraat
KNO3 heeft een smeltpunt van 334°C (633°F). Dit betekent dat KNO3 bij temperaturen boven 334°C zal veranderen van vast naar vloeibaar. Deze eigenschap maakt KNO3 nuttig in toepassingen zoals de glasproductie, waar het wordt gebruikt als vloeimiddel om het smeltpunt van silica te verlagen.
Dichtheid van kaliumnitraat g/ml
De dichtheid van KNO3 is 2,109 g/ml bij kamertemperatuur. Dichtheid is een maat voor de massa per volume-eenheid van een stof. De dichtheid van KNO3 is belangrijk bij toepassingen zoals de productie van kunstmest, waar het wordt gebruikt als bron van stikstof en kalium. De dichtheid is ook nuttig bij het bepalen van de hoeveelheid KNO3 die nodig is in een bepaald volume oplossing.
Kaliumnitraat Molecuulgewicht
Het molecuulgewicht van KNO3 is 101,1 g/mol. Deze waarde wordt berekend door de atoomgewichten van alle atomen in de verbinding op te tellen. Het molecuulgewicht is nuttig voor het berekenen van andere eigenschappen van KNO3, zoals de hoeveelheid KNO3 die nodig is bij een reactie of de concentratie van een oplossing.
Structuur van kaliumnitraat
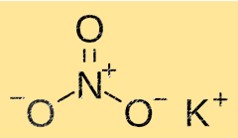
KNO3 heeft een kristalstructuur bestaande uit kalium-, nitraat- en zuurstofionen. Kaliumionen zijn omgeven door zes nitraationen, terwijl nitraationen omgeven zijn door zes kaliumionen. Deze structuur geeft KNO3 zijn karakteristieke eigenschappen zoals oplosbaarheid, smeltpunt en dichtheid.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2,109 g/cm³ bij 20°C |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 101,1032 g/mol |
| Dikte | 2,109 g/cm³ |
| Fusie punt | 334°C (633°F) |
| Kookpunt | 400°C (752°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 133 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in glycerol, ammoniak en water |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 4,75 |
| pH | 6,9 – 7,3 |
Veiligheid en gevaren van kaliumnitraat
KNO3 is relatief veilig als het op de juiste manier wordt gebruikt, maar kan bij onjuist gebruik gevaren met zich meebrengen. Het is geclassificeerd als een oxidatiemiddel, wat betekent dat het de verbranding van andere materialen kan bevorderen. KNO3 kan ook de ogen, huid en luchtwegen irriteren en kan giftig zijn als het in grote hoeveelheden wordt ingenomen of ingeademd. Het is belangrijk om beschermende uitrusting te dragen, zoals handschoenen, een veiligheidsbril en een gasmasker bij het hanteren van KNO3, en om het op een koele, droge plaats op te slaan, uit de buurt van brandbare materialen. Ook moeten de juiste verwijderingsmethoden worden gevolgd om besmetting van het milieu te voorkomen.
| Gevarensymbolen | O, Xn |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. NA INSLIKKEN: Bij onwel voelen een ANTIGIFCENTRUM/arts raadplegen. Spoel je mond. GEEN braken opwekken. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. Een ANTIGIFCENTRUM/arts raadplegen. |
| VN-identificatienummers | 1486 |
| HS-code | 2834.21.00 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | III |
| Toxiciteit | Kan bij inademing irritatie van de luchtwegen, hoesten en kortademigheid veroorzaken. Kan oog- en huidirritatie veroorzaken. Inslikken kan buikpijn, misselijkheid, braken en diarree veroorzaken. Kan giftig zijn bij inslikken of inademen van grote hoeveelheden. |
Synthesemethoden voor kaliumnitraat
Er zijn verschillende methoden om KNO3 te synthetiseren.
Een veel voorkomende methode is de reactie tussen kaliumhydroxide en salpeterzuur . Het reactievat mengt de twee stoffen en verwarmt ze tot een hoge temperatuur, meestal rond de 80°C. Daarna koelt het mengsel af en wint het filtratieproces de vaste KNO3 terug.
Een andere methode is de reactie tussen kaliumchloride en natriumnitraat. Een persoon mengt de twee stoffen in een reactievat en verwarmt ze tot een hoge temperatuur, meestal rond de 600°C.
Het resulterende mengsel smelt en stolt vervolgens, waardoor KNO3-kristallen worden gevormd.
Een derde methode omvat de oxidatie van ammoniak door salpeterzuur in aanwezigheid van een katalysator. Deze methode is complexer en wordt over het algemeen op industriële schaal gebruikt.
KNO3 kan worden gewonnen uit natuurlijke bronnen, zoals grotten en ondergrondse afzettingen. Deze methode is echter minder gebruikelijk vanwege de lage opbrengsten en onzuiverheden in het geëxtraheerde KNO3.
Gebruik van kaliumnitraat
KNO3 heeft vanwege zijn chemische eigenschappen een breed scala aan toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van KNO3:
- Meststof – Wordt gebruikt als meststof vanwege het hoge stikstof- en kaliumgehalte. Het is vooral nuttig voor gewassen die een hoog kaliumgehalte vereisen, zoals fruit, groenten en tabak.
- Voedselconservering – Wordt ook gebruikt als voedselconserveermiddel, vooral in gezouten vlees. Het remt de groei van bacteriën en voorkomt bederf, waardoor de houdbaarheid van het product wordt verlengd.
- Pyrotechniek – Het is een sleutelelement bij de vervaardiging van vuurwerk en andere pyrotechnische apparaten. Het werkt als een oxidatiemiddel en produceert zuurstof om de verbranding van andere materialen te voeden.
- Tandpasta – Toegevoegd aan sommige tandpasta’s om de gevoeligheid van de tanden te verminderen. Het werkt door de overdracht van pijnsignalen van de tandzenuw naar de hersenen te blokkeren.
- Medicinaal gebruik – Medicinaal gebruikt vanwege de diuretische en slijmoplossende eigenschappen. Het behandelt ook angina en hypertensie.
- Industriële toepassingen – Wordt ook gebruikt in diverse industriële toepassingen, zoals de productie van glas, keramiek en kleurstoffen.
Vragen:
Vraag: Is kaliumnitraat oplosbaar in water?
A: Ja, KNO3 is zeer oplosbaar in water. Bij kamertemperatuur kan 100 gram water ongeveer 37 gram KNO3 oplossen.
Vraag: Waar wordt kaliumnitraat voor gebruikt?
A: KNO3 wordt voor verschillende doeleinden gebruikt, waaronder als meststof, voedselconserveermiddel, pyrotechnisch oxidatiemiddel, tandpasta-ingrediënt en als onderdeel bij de productie van glas, keramiek en kleurstoffen.
Vraag: Wat is kaliumnitraat?
A: Kaliumnitraat, ook bekend als salpeter, is een chemische verbinding met de formule KNO3. Het is een ionisch zout bestaande uit kaliumionen (K+) en nitraationen (NO3-).
Vraag: Wat neutraliseert kaliumnitraat?
A: Calcium- en magnesiumionen kunnen de schadelijke effecten van overmatige KNO3 in planten tegengaan. Bij mensen is er geen tegengif bekend voor KNO3-vergiftiging en de behandeling is zeer nuttig.
Vraag: Is kno3 oplosbaar in water?
A: Ja, KNO3 is zeer oplosbaar in water.
Vraag: Wat is een product van waterelektrolyse dat een lage concentratie kno3 bevat?
A: De producten van waterelektrolyse die een lage concentratie KNO3 bevatten, zijn waterstofgas (H2) en zuurstofgas (O2).
Vraag: Wat is kno3?
A: KNO3 is de chemische formule voor kaliumnitraat, ook bekend als salpeter.
Vraag: Wat is de oxidatietoestand van een individueel stikstofatoom in kno3?
A: In KNO3 is de oxidatietoestand van elk stikstofatoom +5.
Vraag: Is kno3 een zuur of een base?
A: KNO3 is noch een zuur, noch een base. Het is een zout, samengesteld uit een kation (K+) en een anion (NO3-).
