Kaliumjodide (KI) is een chemische verbinding die wordt gebruikt om de opname van radioactief jodium door de schildklier te voorkomen. Het is effectief wanneer het vóór of kort na blootstelling aan radioactief jodium wordt ingenomen.
| Naam van IUPAC | Kaliumjodide |
| Moleculaire formule | KI |
| CAS-nummer | 7681-11-0 |
| Synoniemen | kaliumjodide, kaliummonojodide, K-jodide, KI |
| InChi | InChI=1S/HI.K/h1H;/q;+1/p-1 |
Eigenschappen van kaliumjodide
Kaliumjodide-formule
De formule voor kaliumjodide is KI. Deze formule vertegenwoordigt de eenvoudigste verhouding van kalium- en jodiumatomen in de verbinding. De kaliumjodideformule wordt gebruikt om de hoeveelheid verbinding te berekenen die nodig is voor verschillende toepassingen, en om het molecuulgewicht en andere eigenschappen ervan te bepalen.
Kaliumjodide molaire massa
KI heeft een molaire massa van ongeveer 166,0028 g/mol. Deze waarde wordt berekend door de atoomgewichten van K en I in de verbinding op te tellen, die respectievelijk 39,0983 g/mol en 126,9045 g/mol zijn. De molaire massa van KI is belangrijk bij het bepalen van de hoeveelheid verbinding die nodig is bij een bepaalde reactie of toepassing.
Kookpunt van kaliumjodide
Het kookpunt van KI is 1330°C (2426°F). Dit hoge kookpunt is te wijten aan de sterke ionische binding tussen de kalium- en jodiumatomen in de verbinding. KI wordt gebruikt bij toepassingen bij hoge temperaturen vanwege het vermogen om extreme hitte te weerstaan zonder af te breken of zijn effectiviteit te verliezen.
Kaliumjodide Smeltpunt
Het smeltpunt van KI is 681°C (1258°F). Dit relatief lage smeltpunt maakt KI gemakkelijk te hanteren en te verwerken bij gematigde temperaturen. De verbinding wordt vanwege het lage smeltpunt vaak gebruikt bij de productie van fotografische films, farmaceutische producten en nucleaire geneeskunde.
Dichtheid van kaliumjodide g/ml
De dichtheid van KI is 3,123 g/ml. Deze waarde is hoger dan die van water, waardoor KI relatief zwaar en compact is. De dichtheid van KI is belangrijk bij het bepalen van de oplosbaarheid ervan in verschillende oplosmiddelen en bij de toepassingen ervan als stralingsbeschermingsmiddel.
Kaliumjodide Molecuulgewicht
Het molecuulgewicht van KI is ongeveer 166,0028 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van de samenstellende elementen van de verbinding. Het molecuulgewicht van KI is belangrijk voor het bepalen van de eigenschappen ervan en voor het berekenen van de concentratie ervan in oplossingen.
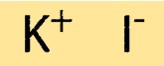
Structuur van kaliumjodide
KI heeft een eenvoudige kristalstructuur, bestaande uit een kubusvormige opstelling in het vlak van K+ en I-ionen. De ionen worden bij elkaar gehouden door sterke ionische bindingen, die de verbinding zijn hoge smelt- en kookpunten geven. De kristalstructuur van KI is belangrijk voor het begrijpen van de fysische en chemische eigenschappen ervan.
| Verschijning | wit kristallijn poeder |
| Specifieke dichtheid | 3.123 |
| Kleur | kleurloos tot wit |
| Geur | geurloos |
| Molaire massa | 166,0028 g/mol |
| Dikte | 3,123 g/ml |
| Fusie punt | 681°C (1258°F) |
| Kookpunt | 1330°C (2426°F) |
| Flitspunt | is niet van toepassing |
| oplosbaarheid in water | 128g/100ml (20°C) |
| Oplosbaarheid | oplosbaar in ethanol, aceton en glycerol |
| Dampdruk | verwaarloosbaar |
| Dampdichtheid | is niet van toepassing |
| pKa | 10.8 |
| pH | 6,0 – 9,0 (5% oplossing) |
Veiligheid en gevaren van kaliumjodide
KI wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt gebruikt. Zoals alle chemicaliën kan het echter gevaren opleveren als het verkeerd wordt behandeld of op de verkeerde manier wordt gebruikt. KI kan de huid, ogen en luchtwegen irriteren, en langdurige blootstelling kan ernstigere gevolgen voor de gezondheid veroorzaken. Het is ook giftig als het in grote hoeveelheden wordt ingenomen. Bij het werken met KI moeten de juiste procedures voor hantering, opslag en verwijdering worden gevolgd. Bovendien moeten persoonlijke beschermingsmiddelen, zoals handschoenen en oogbescherming, worden gedragen bij het hanteren van de verbinding.
| Gevarensymbolen | XI |
| Beveiligingsbeschrijving | Vermijd inademen van stof/rook/gas/nevel/damp/spuitnevel. Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. BIJ CONTACT MET DE OGEN: voorzichtig afspoelen met water gedurende enkele minuten. Verwijder contactlenzen, indien aanwezig en gemakkelijk te doen. Ga door met spoelen. |
| VN-identificatienummers | VN 3077 |
| HS-code | 28276000 |
| Gevarenklasse | 9 – Diverse gevaarlijke materialen |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) > 10.000 mg/kg |
Methoden voor de synthese van kaliumjodide
Er zijn verschillende methoden om KI te synthetiseren, maar een van de meest voorkomende is het laten reageren van jodium met kaliumhydroxide of kaliumcarbonaat in water. De vergelijking voor deze reactie is:
I2 + 2KOH → KI + KIO3 + H2O
Het proces produceert KI, kaliumjodaat en water als bijproducten. Door het mengsel te verwarmen wordt het kaliumjodaat afgebroken en blijft zuiver KI achter.
Een andere methode om KI te synthetiseren omvat het laten reageren van jodium met kaliumbisulfiet in water. Deze reactie produceert zowel KI als zwaveldioxidegas als bijproduct. De vergelijking voor deze reactie is:
I2 + 2KHSO3 → 2KI + 2SO2 + H2O
Het verkregen KI kan worden gezuiverd door herkristallisatie in heet water.
Algen bevatten veel jodium, wat chemici kunnen gebruiken om KI te verkrijgen. Het proces omvat het verbranden van algen om as te produceren, het oplossen van de as in water en het behandelen met kaliumhydroxide om KI te produceren.
Gebruik van kaliumjodide
Hier zijn enkele veelvoorkomende toepassingen van KI:
- Stralingsbescherming: Wordt gebruikt om de schildklier te beschermen tegen straling in geval van een ongeval of een nucleaire aanval. Het werkt door de schildklier te verzadigen met niet-radioactief jodium, wat de opname van radioactieve jodiumisotopen verhindert.
- Medicinale doeleinden: Gebruikt voor de behandeling van schildklieraandoeningen zoals hyperthyreoïdie en struma. Wordt ook gebruikt als voedingssupplement om jodiumtekort te voorkomen.
- Fotografie: Gebruikt als component in fotografische emulsies.
- Analytische chemie: Gebruikt in de analytische chemie om de concentratie van oxidatiemiddelen in een monster te bepalen.
- Organische chemie: Gebruikt in organisch-chemische reacties als bron van jodium.
- Diervoeding: Gebruikt als voeradditief voor vee om jodiumtekort te voorkomen en de algehele gezondheid te verbeteren.
- Zetmeeldetectie: Gebruikt als reagens om de aanwezigheid van zetmeel in oplossingen te detecteren.
- Reductiemiddel: Werkt als reductiemiddel bij bepaalde chemische reacties.
Vragen:
Vraag: Waar kan ik kaliumjodide bij mij in de buurt kopen?
A: U kunt KI bij veel apotheken, natuurvoedingswinkels en online winkels kopen. Het wordt vaak verkocht als voedingssupplement of als stralingsbeschermingsmiddel.
Vraag: Welke cliëntengroep mag geen kaliumjodide krijgen?
A: Mensen met bepaalde schildklieraandoeningen of allergieën voor jodium mogen KI niet gebruiken. Het is belangrijk om een arts te raadplegen voordat u supplementen of medicijnen inneemt.
Vraag: Welke oplossing bevat 6,0 procent (m/m) kaliumjodide (KI) in water?
A: Een 6,0 procent (m/m) oplossing van KI in water betekent dat 6,0 gram KI is opgelost in 100 gram water.
Vraag: Wat is kaliumjodide?
A: KI is een chemische verbinding bestaande uit kalium en jodium. De chemische formule is KI.
Vraag: Is KI ionisch of covalent?
A: Kaliumjodide (KI) is een ionische verbinding. Het wordt gevormd door de elektrostatische aantrekking tussen positief geladen kaliumionen en negatief geladen jodide-ionen.
Vraag: Is KI oplosbaar in water?
A: Ja, kaliumjodide is zeer oplosbaar in water. Bij kamertemperatuur kan ongeveer 140 gram KI worden opgelost in 100 milliliter water.
Vraag: Wat is KI in de chemie?
A: In de scheikunde is KI de chemische formule voor kaliumjodide, een verbinding die wordt gebruikt in een verscheidenheid aan toepassingen, waaronder stralingsbescherming, medicinale doeleinden en analytische chemie.
