Kaliumfluoride (KF) is een chemische verbinding bestaande uit K+- en F–ionen. Het wordt gebruikt in verschillende industriële toepassingen, zoals de productie van aluminium en tandheelkundige producten.
| IUPAC-naam | Kaliumfluoride |
| Moleculaire formule | K.F. |
| CAS-nummer | 7789-23-3 |
| Synoniemen | Kaliummonofluoride, kaliumfluoride, kaliumfluoride, UN 1812, EINECS 232-151-5 |
| InChi | InChI=1S/FH.K/h1H;/q;+1/p-1 |
Eigenschappen van kaliumfluoride
Kaliumfluoride-formule
De chemische formule voor kaliumfluoride is KF, wat aangeeft dat één kaliumion en één fluoride-ion samen één enkele formule-eenheid van de verbinding vormen. De formule voor kaliumfluoride is nuttig voor het bepalen van de stoichiometrie van chemische reacties waarbij de verbinding betrokken is, en voor het identificeren van de elementen die in een bepaald monster aanwezig zijn.
Kaliumfluoride molaire massa
KF heeft een molaire massa van 58,10 g/mol. Het is een verbinding die bestaat uit K+- en F–ionen, met één kaliumion en één fluoride-ion per formule-eenheid. De molmassa is de som van de atoommassa’s van de elementen in een verbinding, in dit geval 39,10 g/mol voor kalium en 19,00 g/mol voor fluor. Het kennen van de molaire massa van KF is nuttig voor het bepalen van de hoeveelheid verbinding die in een bepaald monster aanwezig is, evenals voor het berekenen van stoichiometrische relaties in chemische reacties.
Kookpunt van kaliumfluoride
KF heeft een hoog kookpunt van 1503 ° C (2737 ° F). Dit komt door de sterke ionische binding tussen de K+- en F–ionen, die een grote hoeveelheid energie vereist om te breken en de verbinding in de gasfase te laten komen. Het kookpunt van KF maakt het bruikbaar bij toepassingen bij hoge temperaturen, zoals bij de productie van aluminium, waar het wordt gebruikt als vloeimiddel om onzuiverheden uit het metaal te verwijderen.
Kaliumfluoride Smeltpunt
KF heeft een relatief laag smeltpunt van 858°C (1.576°F). Dit komt ook door de ionische aard van de verbinding, aangezien de sterke aantrekkingskracht tussen positieve en negatieve ionen wordt verzwakt door stijgende temperatuur, waardoor de verbinding in de vloeibare fase kan komen. Het lage smeltpunt van KF maakt het bruikbaar in diverse toepassingen, zoals de productie van glas en keramiek.
Dichtheid van kaliumfluoride g/ml
De dichtheid van KF is 2,48 g/ml bij kamertemperatuur. Deze waarde wordt beïnvloed door de compacte kristalstructuur van de verbinding en de relatief hoge massa van de K+ en F- ionen. De dichtheid van KF is nuttig voor het bepalen van het volume dat wordt ingenomen door een bepaalde massa van de verbinding, en voor het voorspellen van het gedrag ervan in verschillende omgevingen.
Kaliumfluoride Molecuulgewicht
Het molecuulgewicht van KF is 58,10 g/mol. Deze waarde wordt bepaald door het optellen van de atoomgewichten van de K+ en F- ionen in een formule-eenheid van de verbinding. Het molecuulgewicht van KF is belangrijk voor het bepalen van de fysische en chemische eigenschappen ervan, evenals voor het berekenen van stoichiometrische relaties in chemische reacties.
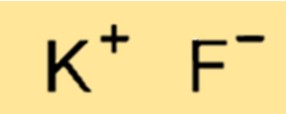
Structuur van kaliumfluoride
KF heeft een kristalstructuur die is samengesteld uit afwisselende K+- en F–ionen. De ionen worden bij elkaar gehouden door sterke ionische bindingen, wat resulteert in een zeer stabiele en stijve structuur. De structuur van KF is belangrijk voor het bepalen van de fysische en chemische eigenschappen ervan, en voor het voorspellen van zijn gedrag in verschillende toepassingen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,48 bij 20°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 58,10 g/mol |
| Dikte | 2,48 g/ml bij 20°C |
| Fusie punt | 858°C |
| Kookpunt | 1503°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 92,5 g/100 ml bij 25°C |
| Oplosbaarheid | Oplosbaar in alcohol, onoplosbaar in ether |
| Dampdruk | 1 mmHg bij 737°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7.3 |
| pH | 7 (neutraal) |
Veiligheid en gevaren van kaliumfluoride
KF kan gevaarlijk zijn als het niet op de juiste manier wordt behandeld. Het is zeer bijtend en kan bij contact ernstige brandwonden aan de huid, ogen en luchtwegen veroorzaken. Inademing van KF-stof of -damp kan de luchtwegen irriteren en hoesten en kortademigheid veroorzaken. Langdurige blootstelling aan KF kan chronische longschade en skeletfluorose veroorzaken. Het is belangrijk om bij het hanteren van KF beschermende uitrusting te gebruiken, zoals handschoenen en een veiligheidsbril, en om te voorkomen dat het stof of de dampen ervan worden ingeademd. Bij blootstelling moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Schedel met gekruiste knekels, bijtend |
| Beveiligingsbeschrijving | Achter slot en buiten bereik van kinderen bewaren. Stof niet inademen. Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. Bij een ongeval of als u zich onwel voelt, dient u onmiddellijk medische hulp in te roepen (indien mogelijk het etiket tonen). |
| VN-identificatienummers | VN1812 |
| HS-code | 2826.12.00 |
| Gevarenklasse | 6.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig; Orale LD50 (rat) 52 mg/kg |
Synthesemethoden voor kaliumfluoride
Er zijn verschillende methoden om KF te synthetiseren. Een gebruikelijke methode is om fluorwaterstofzuur (HF) te laten reageren met kaliumhydroxide (KOH) . De reactie produceert KF en water, als volgt:
HF + KOH → KF + H2O
Een andere methode is de reactie tussen kaliumcarbonaat (K2CO3) en fluorwaterstofzuur . De reactie produceert KF, water en kooldioxide, als volgt:
2HF + K2CO3 → 2KF + CO2 + H2O
Bij hoge temperaturen produceert de reactie tussen waterstoffluoridegas (HF) en kaliumchloride (KCl) KF en waterstofchloridegas (HCl).
KCl + HF → KF + HCl
De bovenstaande methoden vereisen voorzichtigheid omdat fluorwaterstofzuur of waterstoffluoride zeer corrosief en giftig zijn.
Gebruik van kaliumfluoride
Kaliumfluoride heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Als vloeimiddel in de metallurgie: gebruikt als vloeimiddel bij de productie van aluminium en andere metalen. Het helpt onzuiverheden uit het metaal te verwijderen en de kwaliteit ervan te verbeteren.
- Bij de productie van andere chemicaliën: Gebruikt bij de productie van verschillende andere chemicaliën, zoals kryoliet en aluminiumfluoride.
- Bij de glasproductie: toegevoegd aan glas om het smeltpunt te verlagen en de duurzaamheid en optische eigenschappen te verbeteren.
- Bij de productie van pesticiden: Gebruikt bij de productie van bepaalde pesticiden als stabilisator en katalysator.
- Bij de productie van tandpasta: toegevoegd aan tandpasta als fluoridesupplement om tandbederf te voorkomen.
- In kernreactoren: Gebruikt in kernreactoren als koelmiddel en om corrosie van reactoronderdelen te voorkomen.
- In analytische chemie: Gebruikt in analytische chemie om de concentratie van bepaalde elementen in een monster te bepalen.
Vragen:
Vraag: Wat is KF in de chemie?
A: KF is de chemische formule voor kaliumfluoride. Het is een anorganische verbinding bestaande uit een kaliumion en een fluoride-ion.
Vraag: Is KF een zuur of een base?
A: KF is een zout dat noch een zuur noch een base is. Het kan echter hydrolyse in water ondergaan om een basische oplossing te produceren.
Vraag: Geleidt kaliumfluoride elektriciteit?
A: KF is een ionische verbinding die elektriciteit kan geleiden wanneer deze in water wordt opgelost of gesmolten. Ionen kunnen zich inderdaad vrij bewegen en een elektrische lading dragen.
Vraag: Wat is de formule voor kaliumfluoride?
A: De formule voor kaliumfluoride is KF. De verbinding bestaat uit een K+-ion en een F-ion.
