Kaliumcyanide is een zeer giftige verbinding. Het wordt gebruikt in industriële toepassingen en kan ernstige schade veroorzaken als het wordt ingeslikt. Bij de omgang ermee moet uiterste voorzichtigheid worden betracht.
| IUPAC-naam | Kaliumcyanide |
| Moleculaire formule | KCN |
| CAS-nummer | 151-50-8 |
| Synoniemen | Kaliumcyanide, kaliumzout van blauwzuur |
| InChi | InChI=1S/CN.K/c1-2;/q-1;+1 |
Eigenschappen van kaliumcyanide
Kaliumcyanideformule
De chemische formule voor kaliumcyanide is KCN. Het bestaat uit een K-atoom gebonden aan een CN-ion. De formule vertegenwoordigt de verhouding van atomen in een KCN-molecuul.
Kaliumcyanide Molaire massa
De molaire massa van KCN wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. K heeft een atoommassa van 39,10 g/mol, terwijl CN een gecombineerde atoommassa heeft van 26,01 g/mol. De molaire massa van KCN is daarom 65,11 g/mol.
Kookpunt van kaliumcyanide
KCN heeft een hoog kookpunt van ongeveer 1.634 graden Celsius (2.963 graden Fahrenheit). Deze temperatuur geeft het punt aan waarop de vloeibare vorm van KCN in een gas verandert.
Kaliumcyanide Smeltpunt
Het smeltpunt van KCN is ongeveer 634 graden Celsius (1173 graden Fahrenheit). Deze temperatuur vertegenwoordigt de overgang van de vaste toestand naar de vloeibare toestand.
Dichtheid van kaliumcyanide g/ml
De dichtheid van KCN is ongeveer 1,52 g/ml. Deze meting geeft de massa van de stof per volume-eenheid aan, waarbij een hogere dichtheid een grotere massa in een bepaald volume aangeeft.
Kaliumcyanide Molecuulgewicht
Het molecuulgewicht van KCN, ook wel molmassa genoemd, is 65,11 g/mol. Deze waarde vertegenwoordigt de som van de atoommassa’s van alle atomen in een KCN-molecuul.
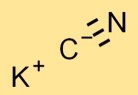
Structuur van kaliumcyanide
De structuur van KCN bestaat uit een K+ kation en een CN-anion. Het K+-ion is positief geladen, terwijl het CN-ion een negatieve lading heeft. Ze worden bij elkaar gehouden door ionische bindingen.
Oplosbaarheid van kaliumcyanide
KCN is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een kleurloze oplossing. Deze eigenschap vergemakkelijkt de hantering en het gebruik ervan in verschillende industriële toepassingen. De oplosbaarheid ervan betekent echter ook dat er voorzichtig mee moet worden omgegaan.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,52 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 65,11 g/mol |
| Dikte | 1,52 g/ml |
| Fusie punt | 634 graden Celsius (1.173 graden Fahrenheit) |
| Kookpunt | 1.634 graden Celsius (2.963 graden Fahrenheit) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Basisch (alkalisch) |
Kaliumcyanide Veiligheid en gevaren
KCN brengt aanzienlijke veiligheidsrisico’s met zich mee en moet met uiterste voorzichtigheid worden behandeld. Het is zeer giftig als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Direct contact met KCN kan ernstige brandwonden en irritatie veroorzaken. Bij blootstelling aan zuren of verhitting komt giftig HCN-gas vrij. Goede ventilatie en persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, zijn essentieel bij het werken met dit middel. De opslag moet plaatsvinden in een veilige, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Bij blootstelling of inslikken is onmiddellijke medische hulp essentieel. KCN-gevaren vereisen een strikte naleving van veiligheidsprotocollen om de risico’s voor de menselijke gezondheid en het milieu te minimaliseren.
| Gevarensymbolen | Schedel met gekruiste knekels, bijtend |
| Beveiligingsbeschrijving | Zeer giftig, Bijtend, Gevaarlijk voor het milieu |
| VN-identificatienummers | VN1680, VN1585 |
| HS-code | 2837.11.00 |
| Gevarenklasse | 6.1 (giftige stoffen), 8 (bijtende stoffen) |
| Verpakkingsgroep | GE II |
| Toxiciteit | Extreem giftig |
Synthesemethoden voor kaliumcyanide
Verschillende methoden maken de synthese van KCN mogelijk.
Bij een gebruikelijke methode omvat de synthese van KCN het borrelen van een oplossing van HCN-gas door een oplossing van kaliumhydroxide (KOH). De reactie tussen de twee verbindingen genereert KCN en water als bijproduct.
Bij deze methode reageert kaliumcarbonaat (K2CO3) met NH4CN wanneer ze worden gemengd en verwarmd. Als resultaat produceert de reactie KCN, ammoniak en kooldioxide.
Om KCN te verkrijgen, kan kaliumchloride (KCl) worden gereageerd met NaCN, wat resulteert in een ionenuitwisseling tussen de verbindingen. Dit proces leidt tot de vorming van KCN en natriumchloride (NaCl) .
Professionals met expertise in het omgaan met gevaarlijke materialen en die de noodzakelijke veiligheidsmaatregelen hebben geïmplementeerd, mogen uitsluitend KCN-synthese uitvoeren. Vanwege de extreme toxiciteit van KCN is strikte naleving van de juiste laboratoriumpraktijken en -protocollen van cruciaal belang om de veiligheid van de betrokkenen te garanderen en mogelijke gevaren voor het milieu te voorkomen.
Gebruik van kaliumcyanide
KCN heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de toepassingen:
- Goudwinning: Goudmijnbedrijven gebruiken KCN vaak om goud uit erts te winnen. Ze mengen het met het erts om een oplosbaar complex te vormen dat het goud van andere mineralen scheidt.
- Chemische industrie: De chemische industrie gebruikt KCN als voorloper voor de productie van verschillende chemicaliën, waaronder organische cyaniden, adiponitril en kaliumferrocyanide. Fabrikanten gebruiken deze verbindingen bij de productie van farmaceutische producten, kleurstoffen en pigmenten.
- Metaalplateren: KCN speelt een cruciale rol bij galvaniseerprocessen en zorgt voor een gladde, hechtende metaalcoating op oppervlakken. Het is bijzonder effectief voor verzilveren en verzinken.
- Analytische chemie: Analytische laboratoria gebruiken KCN als reagens voor verschillende analytische technieken. Het vindt toepassing bij titratiereacties en dient als bron van cyanide-ionen bij complexometrische titraties.
- Ongediertebestrijding: In sommige gevallen fungeert KCN als een rodenticide om knaagdierpopulaties onder controle te houden. Er gelden echter strikte regels voor het gebruik ervan vanwege de extreem giftige aard ervan.
- Fumigatie: KCN dient vanwege de hoge toxiciteit als een effectief ontsmettingsmiddel om ongedierte in opgeslagen granen, scheepsladingen en constructies uit te roeien, waardoor een effectieve ongediertebestrijding wordt gegarandeerd.
- Fotografie: Historisch gezien gebruikte de fotografie-industrie KCN om zwart-witfilms te ontwikkelen en te repareren. Om veiligheidsredenen worden alternatieve chemicaliën echter op grote schaal gebruikt in de industrie.
Het is essentieel op te merken dat het gebruik van KCN strikte naleving van veiligheidsprotocollen en -voorschriften vereist vanwege de zeer giftige aard ervan.
Vragen:
Vraag: Hoe kaliumcyanide maken?
A: De synthese van KCN omvat verschillende methoden, waaronder de reactie van KOH met HCN of K2CO3 met ammoniumcyanide (NH4CN).
Vraag: Wat is kaliumcyanide?
A: Het is een zeer giftige verbinding met de chemische formule KCN. Het is een witte kristallijne vaste stof die wordt gebruikt in de goudwinning, chemische productie en andere industriële toepassingen.
Vraag: Waar kun je kaliumcyanide kopen in Thailand?
A: Het is illegaal en zeer gevaarlijk om KCN te kopen of te bezitten zonder de juiste toestemming of voor legitieme wetenschappelijke doeleinden.
Vraag: Remt cyanide de natrium-kaliumpomp?
A: Ja, cyanide remt de Na-K-pomp, waardoor cellulaire processen worden verstoord en ernstige toxiciteit wordt veroorzaakt.
Vraag: Hoe maak je kaliumgoudcyanide?
A: K[Au(CN)₂] wordt geproduceerd door goud op te lossen in een oplossing die KCN bevat. Het proces omvat galvaniseren of reactie met KCN in aanwezigheid van zuurstof.
Vraag: Is kaliumcyanide aanwezig in rattengif?
A: KCN wordt over het algemeen niet gebruikt in commerciële rattenvergiften. Andere verbindingen, zoals anticoagulantia of zinkfosfide, worden vaak gebruikt om knaagdieren te bestrijden.
Vraag: Hoe smaakt kaliumcyanide?
A: Er wordt beschreven dat KCN een bittere amandelsmaak heeft. Het is echter zeer giftig en inname ervan kan dodelijk zijn, zelfs in kleine hoeveelheden.
Vraag: Is kaliumcyanide giftig?
A: Ja, KCN is uiterst giftig. Het remt de cellulaire ademhaling, wat leidt tot weefselschade, orgaanfalen en mogelijk de dood.
Vraag: Kan ik kaliumcyanide kopen in Groot-Brittannië?
A: Het kopen, bezitten of verkopen van KCN zonder de juiste toestemming of voor legitieme wetenschappelijke doeleinden is illegaal en streng gereguleerd in Groot-Brittannië.
Vraag: Wat veroorzaakt kaliumcyanide?
A: KCN kan ernstige toxiciteit veroorzaken, wat leidt tot symptomen zoals ademhalingsmoeilijkheden, duizeligheid, misselijkheid, convulsies en, bij hoge doses, een snelle dood.
Vraag: Waar kun je kaliumcyanide krijgen?
A: De overname van KCN is beperkt en strikt gereguleerd. Het is voornamelijk verkrijgbaar bij erkende chemische leveranciers voor legitieme wetenschappelijke, industriële en onderzoeksdoeleinden.
