Kaliumchloride (KCl) is een verbinding die kalium en chloor bevat. Het wordt gebruikt als meststof, voedseladditief en medische behandeling voor lage kaliumspiegels. Het kan ook worden gebruikt bij dodelijke injecties.
| IUPAC-naam | Kaliumchloride |
| Moleculaire formule | KCl |
| CAS-nummer | 7447-40-7 |
| Synoniemen | KCl, Kalium Chloratum, Kaliumzout, Sylviet, Chloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChi | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Kaliumchloride-formule
De chemische formule voor kaliumchloride is KCl. Het is een binaire verbinding bestaande uit één kaliumatoom en één chlooratoom. De formule van kaliumchloride is belangrijk voor het begrijpen van de chemische eigenschappen ervan en voor het uitvoeren van berekeningen met betrekking tot het gebruik ervan in verschillende toepassingen.
Molaire massa kaliumchloride
De molaire massa van KCl is 74,55 g/mol. Het is een witte kristallijne vaste stof met een zoute smaak en zeer oplosbaar in water. KCl is een verbinding die bestaat uit één kaliumatoom en één chlooratoom.
Kookpunt van kaliumchloride
Het kookpunt van KCl is 1420 ° C (2588 ° F). Het is een verbinding met een hoog smeltpunt die aanzienlijke energie nodig heeft om zijn kookpunt te bereiken. Het hoge kookpunt van KCl maakt het bruikbaar bij toepassingen bij hoge temperaturen, zoals bij de productie van keramiek en glas.
Smeltpunt van KCl
Het smeltpunt van KCl is 770°C (1.418°F). Het is een verbinding met een relatief hoog smeltpunt, waarvoor aanzienlijke hitte nodig is om te smelten. KCl wordt gebruikt bij de productie van kunstmest en het hoge smeltpunt zorgt voor stabiliteit bij hoge temperaturen.
KCl-dichtheid g/ml
De dichtheid van KCl is 1,98 g/cm³. Het is een relatief dichte verbinding, wat betekent dat een kleine hoeveelheid een groot aantal deeltjes bevat. De hoge dichtheid van KCl maakt het nuttig in bepaalde industriële toepassingen, zoals bij de productie van boorvloeistoffen.
Molecuulgewicht van KCl
Het molecuulgewicht van KCl is 74,55 g/mol. Het is een relatief lichte verbinding, wat betekent dat het een klein aantal deeltjes bevat. Het lage molecuulgewicht van KCl maakt het gemakkelijk te transporteren en te hanteren in industriële omgevingen.
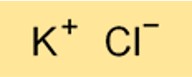
KCl-structuur
De structuur van KCl is een ionisch kristalrooster. Het bestaat uit afwisselende kalium- en chloorionen, gerangschikt in een zich herhalend patroon. De ionische aard van de structuur betekent dat KCl een goede geleider van elektriciteit is wanneer opgelost in water.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,98 g/cm³ |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 74,55 g/mol |
| Dikte | 1,98 g/cm³ |
| Fusie punt | 770°C (1.418°F) |
| Kookpunt | 1420°C (2588°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 34,7 g/100 ml (0°C) |
| Oplosbaarheid | Oplosbaar in water, glycerol en formamide; enigszins oplosbaar in ethanol |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | -1,8 (geconjugeerd zuur) |
| pH | 7 (10% oplossing) |
Kaliumchlorideveiligheid en gevaren
Kaliumchloride (KCl) brengt potentiële gevaren en veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden bij het hanteren of gebruiken ervan. Dit kan huid- en oogirritatie veroorzaken en langdurige blootstelling kan leiden tot chemische brandwonden. Inademing van KCl-stof kan irritatie van de luchtwegen en hoesten veroorzaken. Bovendien kan de inname van grote hoeveelheden KCl leiden tot verstoorde elektrolytenbalans en hartritmestoornissen. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en oogbescherming, en om KCl in een goed geventileerde ruimte te hanteren. Bij contact met de huid of ogen is het belangrijk om het aangetaste gebied grondig te spoelen en indien nodig een arts te raadplegen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Schadelijk bij inslikking. |
| EEN ID | VN1480 |
| HS-code | 310420 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | LD50 (rat, oraal): 2.500 mg/kg |
Synthesemethoden voor kaliumchloride
Er zijn verschillende methoden om kaliumchloride (KCl) te synthetiseren, waaronder:
- Oplossen en kristalliseren: Bij deze methode wordt KCl in water opgelost en vervolgens de oplossing laten verdampen, waardoor vaste KCl-kristallen achterblijven.
- Ionenuitwisseling: Om KCl te produceren, kunnen ionen in een oplossing van een ander zout, zoals natriumchloride, worden uitgewisseld met kaliumionen. Industrieën gebruiken deze methode vaak bij de productie van KCl-meststoffen.
- Elektrolyse: Elektrolyse van een KCl-oplossing produceert elementair kalium- en chloorgas, dat samen KCl vormt.
- Reactie van kaliumhydroxide met zoutzuur : Kaliumhydroxide kan reageren met zoutzuur om KCl en water te produceren.
- Reactie van kaliumcarbonaat met zoutzuur: Kaliumcarbonaat kan reageren met zoutzuur om KCl, kooldioxide en water te produceren.
Elke methode heeft zijn eigen voor- en nadelen, en de keuze van de methode kan afhangen van factoren zoals de vereiste zuiverheid van het product, de productieschaal en de kosten van grondstoffen en apparatuur.
Gebruik van kaliumchloride
Kaliumchloride heeft een breed scala aan toepassingen, waaronder:
- Meststof: Gebruikt als meststof om essentiële voedingsstoffen voor de plantengroei te leveren.
- Voedseladditief: Gebruikt als vervanging voor zout in bewerkte voedingsmiddelen om de natriuminname te verminderen.
- Waterbehandeling: toegevoegd aan waterbehandelingssystemen om corrosie en kalkvorming te voorkomen.
- Medische toepassingen: Gebruikt in intraveneuze vloeistoffen en orale rehydratatieoplossingen om elektrolyten te vervangen en aandoeningen zoals hypokaliëmie te behandelen.
- Industriële toepassingen: Gebruikt bij de productie van glas, keramiek en zepen, en als grondstof bij de productie van andere chemicaliën.
- Dierenvoer: toegevoegd aan diervoer om essentiële voedingsstoffen te leveren.
- Ontijzingsmiddel: Wordt gebruikt als ontijzingsmiddel om ijs en sneeuw op wegen en trottoirs te smelten.
- Olie- en gasboringen: gebruikt als kleistabilisator bij olie- en gasboringen.
- Laboratoriumreagens: Gebruikt als reagens bij laboratoriumexperimenten en analyses.
Vragen:
Vraag: Wat is kaliumchloride?
A: Kaliumchloride (KCl) is een wit kristallijn zout dat bestaat uit kalium- en chloorionen. Het heeft vele toepassingen in industrieën zoals de landbouw, voeding, geneeskunde en chemische productie.
Vraag: Waar wordt kaliumchloride voor gebruikt?
A: Kaliumchloride wordt vaak gebruikt als meststof, voedseladditief en in medische toepassingen om aandoeningen zoals hypokaliëmie te behandelen. Het kan ook worden gebruikt bij waterbehandeling, industriële processen, dierenvoeding, ontdooien, olie- en gasboringen en laboratoriumexperimenten.
Vraag: Is kaliumchloride veilig?
A: Kaliumchloride kan schadelijk zijn als het in grote hoeveelheden wordt ingenomen of als het in contact komt met de ogen of de huid. Het is belangrijk om de juiste veiligheidsrichtlijnen en -voorschriften te volgen bij het hanteren of gebruiken van kaliumchloride.
Vraag: Is KCl oplosbaar in water?
A: Ja, KCl is zeer oplosbaar in water. Bij kamertemperatuur kan één gram KCl oplossen in 1,5 ml water.
Vraag: Is KCl ionisch of covalent?
A: KCl is een ionische verbinding omdat het bestaat uit positief geladen kaliumionen en negatief geladen chloride-ionen die bij elkaar worden gehouden door ionische bindingen.
Vraag: Is KCl een zuur of een base?
A: Kaliumchloride is een neutrale verbinding en is noch een zuur, noch een base.
Vraag: Is KCl een sterke elektrolyt?
A: Ja, KCl is een krachtige elektrolyt omdat het volledig dissocieert in kalium- en chloride-ionen wanneer het wordt opgelost in water, waardoor elektrische geleiding mogelijk is.
