Kaliumchloraat (KClO3) is een chemische verbinding bestaande uit kalium, chloor en zuurstof. Vanwege de oxiderende eigenschappen wordt het vaak gebruikt bij de vervaardiging van lucifers, explosieven en vuurwerk.
| IUPAC-naam | Kaliumchloride |
| Moleculaire formule | KClO3 |
| CAS-nummer | 3811-04-9 |
| Synoniemen | Kaliumchloraat, Chlorkalic, Kaliumchloraat, Kaliumperchloraat, UN 1485, Kaliumchloraat, Kaliumperchloricum |
| InChi | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Eigenschappen van kaliumchloraat
Kaliumchloraatformule
Kaliumchloraat heeft de chemische formule KClO3, wat aangeeft dat het bestaat uit één kaliumatoom, één chlooratoom en drie zuurstofatomen. Het is een ionische verbinding die ontstaat wanneer K+- en ClO3–ionen via een ionische binding worden gecombineerd. De verbinding is zeer reactief vanwege de aanwezigheid van zuurstof, waardoor deze sterke oxiderende eigenschappen heeft.
Kaliumchloraat Molaire massa
De molaire massa van KClO3 bedraagt 122,55 g/mol. Het is de som van de atoommassa’s van de afzonderlijke elementen waaruit de verbinding bestaat, namelijk kalium, chloor en zuurstof. Molaire massa is een belangrijke parameter in de chemie omdat deze wordt gebruikt om de massa te berekenen van een stof die nodig is om een bepaalde hoeveelheid product te produceren in een chemische reactie.
Kookpunt van kaliumchloraat
KClO3 heeft geen goed gedefinieerd kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt het uiteen in kaliumchloride en zuurstofgas. Daarom ondergaat KClO3 een thermische ontledingsreactie in plaats van een kookpunt.
Kaliumchloraat Smeltpunt
Het smeltpunt van KClO3 is 356°C (673°F). Bij deze temperatuur smelt de vaste verbinding en verandert in een vloeistof. Het smeltpunt is een essentiële eigenschap van een verbinding omdat het het fysieke gedrag van de stof beïnvloedt, inclusief de oplosbaarheid en dichtheid ervan.
Dichtheid van kaliumchloraat g/ml
De dichtheid van KClO3 is 2,32 g/ml bij kamertemperatuur. Dit betekent dat een specifiek volume van de verbinding een bepaalde massa heeft, wat handig is bij het bepalen van de massa van een stof die nodig is voor een bepaalde chemische reactie. De dichtheid van KClO3 heeft ook invloed op de oplosbaarheid ervan in water, omdat verbindingen met een hogere dichtheid doorgaans minder oplosbaar zijn in water.
Kaliumchloraat Molecuulgewicht
Het molecuulgewicht van KClO3 bedraagt 122,55 g/mol. Het is de som van de atoomgewichten van de samenstellende atomen, namelijk kalium, chloor en zuurstof. Molecuulgewicht is een essentiële parameter in de stoichiometrie omdat het wordt gebruikt om de hoeveelheden reactanten en producten in een chemische reactie te berekenen.
Structuur van kaliumchloraat
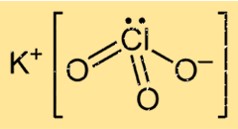
KClO3 heeft in vaste vorm een kristalstructuur, bestaande uit kalium-, chloor- en zuurstofatomen die in een specifiek patroon zijn gerangschikt. De verbinding vormt een kubusvormige kristalroosterstructuur met het gezicht in het midden, waarin elk kaliumion wordt omgeven door zes zuurstofatomen en elk zuurstofion wordt omgeven door vier kaliumatomen en twee chlooratomen.
Oplosbaarheid van kaliumchloraat
KClO3 is matig oplosbaar in water, met een oplosbaarheid van 7 g/100 ml water bij kamertemperatuur. De oplosbaarheid van de verbinding neemt toe met de temperatuur, omdat watermoleculen meer kinetische energie hebben en meer van de verbinding kunnen oplossen. KClO3 is ook oplosbaar in andere polaire oplosmiddelen zoals ethanol en aceton.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,32 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 122,55 g/mol |
| Dikte | 2,32 g/cm³ |
| Fusie punt | 356°C (673°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 7 g/100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in ethanol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | De pH van een 0,1 M oplossing is ongeveer 6,5 tot 7,5 |
Veiligheid en gevaren van kaliumchloraat
KClO3 is een zeer reactieve en potentieel gevaarlijke stof, dus er moet uiterst voorzichtig mee worden omgegaan. Het kan ernstige huid- en oogirritatie veroorzaken en kan giftig zijn bij inslikken of inademen. Bij verhitting kan het heftig reageren en zelfs exploderen. KClO3 kan ook sterk reageren met andere chemicaliën, zoals zwavelzuur en organische verbindingen, en giftige gassen zoals chloor en chloraatdioxide produceren. Het is belangrijk om de juiste veiligheidsprotocollen te volgen bij het werken met KClO3, inclusief het dragen van beschermende uitrusting en het werken in een goed geventileerde ruimte.
| Gevarensymbolen | O, Xi, N |
| Beveiligingsbeschrijving | Vermijd contact met brandbare materialen. Giftig bij inslikken. Veroorzaakt ernstige brandwonden en oogletsel. |
| VN-identificatienummers | VN1485 |
| HS-code | 2829.90.10 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Kaliumchloraatsynthesemethoden
Er zijn verschillende methoden om KClO3 te synthetiseren.
Eén methode omvat de reactie tussen kaliumchloride en bleekmiddel. Deze methode omvat het toevoegen van een bleekoplossing aan een kaliumchlorideoplossing en het roeren van het mengsel. Om KClO3 te verkrijgen, filtreert en wast u het verkregen neerslag.
Een andere methode omvat de elektrolyse van een oplossing die kaliumchloride , water en een zuurstofbron bevat. Een elektrolytische cel, een gespecialiseerd apparaat, voert dit proces uit door kalium- en chloride-ionen te scheiden en zuurstofgas te produceren. Zuurstof reageert met kaliumionen en vormt KClO3.
Een derde methode omvat de reactie tussen kaliumhydroxide en chloorgas, waarbij KClO3 ontstaat met kaliumchloride en water. Deze methode vereist een zorgvuldige controle van de temperatuur en concentratie van reagentia om optimale opbrengsten te garanderen.
Gebruik van kaliumchloraat
KClO3 heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Pyrotechnische producten: Vaak gebruikt als oxidatiemiddel in vuurwerk en andere pyrotechnische apparaten.
- Lucifers: Gebruikt in veiligheidsluciferkoppen, die ontbranden wanneer ze tegen een ruw oppervlak worden geslagen.
- Meststof: Gebruikt als kaliumbron voor plantenmeststoffen.
- Bleekmiddel: Gebruikt als bleekmiddel voor textiel, papier en andere materialen.
- Laboratoriumreagens: Wordt ook gebruikt als laboratoriumreagens voor verschillende chemische reacties.
- Medische toepassingen: medicinaal gebruikt om bepaalde soorten huidaandoeningen te behandelen, zoals eczeem.
- Explosieven: Een veelgebruikt ingrediënt in sommige soorten explosieven, zoals ontstekers en dynamiet.
- Oxidatiemiddel: Gebruikt als oxidatiemiddel bij de productie van bepaalde chemicaliën, zoals perchloraten.
Vragen:
Vraag: Hoeveel gram kaliumchloride wordt geproduceerd als 25 g kaliumchloraat ontleedt?
A: Wanneer 25 g KClO3 ontleedt, produceert het 13,47 g kaliumchloride.
Vraag: Hoe maak je kaliumchloraat?
A: KClO3 kan worden gemaakt door kaliumchloride te laten reageren met bleekmiddel, door elektrolyse van een oplossing die kaliumchloride bevat, of door kaliumhydroxide te laten reageren met chloorgas.
Vraag: Hoeveel mol zuurstof wordt er geproduceerd als 2 mol kaliumchloraat (kclo3) ontleedt?
A: Wanneer 2 mol KClO3 ontleedt, ontstaat er 3 mol zuurstofgas.
Vraag: Een oplossing van 0,70 m bevat 3,0 g kaliumchloraat (kclo3). Wat is het volume van de oplossing?
A: Het volume van de 0,70 ml oplossing die 3,0 g KClO3 bevat, is 51,4 ml.
Vraag: Is kaliumchloraat vluchtig?
A: KClO3 wordt niet als een vluchtige stof beschouwd omdat het een relatief hoog smelt- en kookpunt heeft.
Vraag: Hoeveel kcl wordt geproduceerd als je 2,50 g kclo3 ontbindt?
A: Wanneer 2,50 g KClO3 ontleedt, ontstaat er 1,35 g kaliumchloride.
Vraag: Is kclo3 oplosbaar in water?
A: Ja, KClO3 is zeer oplosbaar in water, met een oplosbaarheid van 7 g/100 ml bij kamertemperatuur.
Vraag: Hoeveel gram zuurstof kan worden geproduceerd uit de ontbinding van 100 g kclo3?
A: Wanneer 100 g KClO3 ontleedt, ontstaat er 45,02 g zuurstofgas.
