Kaliumbromide (KBr) is een chemische verbinding bestaande uit kalium en broom. Het wordt vaak gebruikt in de fotografie, geneeskunde en diergeneeskunde als anticonvulsivum voor honden.
| IUPAC-naam | Kaliumbromide |
| Moleculaire formule | KBr |
| CAS-nummer | 7758-02-3 |
| Synoniemen | Kaliumbromide, Kaliumbromidezout, Kaliobromide, Broomkalium |
| InChi | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
Eigenschappen van kaliumbromide
Kaliumbromide-formule
De chemische formule voor kaliumbromide is KBr. Deze formule vertegenwoordigt de verhouding van atomen in de verbinding. Het K+-ion heeft een lading van +1 en het Bri-ion heeft een lading van -1, wat resulteert in een neutrale verbinding. De formule wordt gebruikt om de samenstelling van de verbinding aan te geven en is essentieel voor het schrijven van evenwichtige chemische vergelijkingen.
Kaliumbromide molaire massa
KBr heeft een molaire massa van 119,01 g/mol. Het bestaat uit één kaliumatoom en één broomatoom. Molaire massa is een belangrijk kenmerk van een verbinding omdat deze wordt gebruikt om het aantal mol van een stof in een bepaald monster te bepalen. Het wordt ook gebruikt in de stoichiometrie om de massa van een product of reactant in een chemische reactie te berekenen.
Kookpunt van kaliumbromide
KBr heeft een kookpunt van 1390 ° C (2534 ° F). Dit hoge kookpunt is te wijten aan de ionische aard van de verbinding. Bij verhitting vereisen de ionische bindingen tussen kalium en broom een grote hoeveelheid energie om te verbreken, wat resulteert in een hoog kookpunt. KBr wordt in het laboratorium vaak gebruikt als warmteoverdrachtsvloeistof vanwege het hoge kookpunt.
Kaliumbromide Smeltpunt
KBr heeft een smeltpunt van 734°C (1.353°F). Net als het kookpunt wordt ook het smeltpunt bepaald door de sterkte van de ionische bindingen tussen de kalium- en broomatomen. Bij verhitting worden de ionische bindingen verzwakt en wordt de kristalroosterstructuur van de verbinding afgebroken, wat resulteert in een vloeibare toestand.
Dichtheid van kaliumbromide g/ml
De dichtheid van KBr is 2,75 g/ml bij kamertemperatuur. De dichtheid van een stof wordt gedefinieerd als de massa van een stof per volume-eenheid. De hoge dichtheid van KBr is te wijten aan de strakke kristalstructuur van de verbinding. Deze eigenschap maakt het nuttig bij het maken van optische materialen zoals lenzen en prisma’s.
Kaliumbromide Molecuulgewicht
Het molecuulgewicht van KBr is 119,01 g/mol. Deze waarde wordt berekend door de atoommassa’s van kalium en broom op te tellen. Het molecuulgewicht wordt gebruikt bij chemische berekeningen, zoals het bepalen van de hoeveelheid van een stof die nodig is om een oplossing met een specifieke concentratie te bereiden.
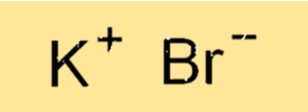
Structuur van kaliumbromide
KBr heeft een kristalstructuur die bestaat uit een kubisch rooster met het gezicht in het midden. Elk K+-ion is omgeven door zes Bri-ionen, en elk Bri-ion is omgeven door zes K+-ionen. Deze rangschikking is kenmerkend voor ionische verbindingen, die een regelmatige, zich herhalende rangschikking van ionen in de kristalstructuur hebben.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,75 g/ml bij 25°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 119,01 g/mol |
| Dikte | 2,75 g/cm³ |
| Fusie punt | 734°C (1.353°F) |
| Kookpunt | 1390°C (2534°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 53 g/100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in alcohol, aceton en ammoniak |
| Dampdruk | 1 mmHg bij 1114°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7,5 (bij 25°C) |
| pH | 7 (neutraal) |
Veiligheid en gevaren van kaliumbromide
KBr wordt over het algemeen als veilig in gebruik beschouwd, maar kan bij verkeerd gebruik enkele gevaren met zich meebrengen. Het is irriterend voor de huid, de ogen en de luchtwegen en de inname ervan kan maag- en darmklachten veroorzaken. Langdurige blootstelling aan hoge concentraties kan ademhalingsproblemen veroorzaken. KBr moet met zorg worden gehanteerd en geschikte persoonlijke beschermingsmiddelen, inclusief handschoenen en een stofmasker, moeten worden gedragen bij het hanteren van de verbinding. Het is ook belangrijk om KBr op te slaan in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen. Bij blootstelling dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Xi – Irriterend |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag geschikte beschermende kleding, handschoenen en een veiligheidsbril/gelaatsscherm |
| bescherming. | |
| VN-identificatienummers | UN 1465 (Chemische stoffen, kaliumbromide) |
| HS-code | 28275100 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) = 2,340 mg/kg |
Methoden voor de synthese van kaliumbromide
Om KBr te synthetiseren kunnen verschillende methoden worden gebruikt, zoals directe synthese, dubbele ontleding en zuur-base-titratie.
KOH reageert met HBr-gas om KBr te produceren in directe synthese. De reactie produceert KBr en water als bijproducten.
Dubbele ontleding omvat de reactie van een oplosbaar kaliumzout met een oplosbaar bromidezout, zoals kaliumchloride en natriumbromide. De reactie produceert KBr en natriumchloride .
Zuur-base-titratie omvat de reactie van een bromidezout met KOH . Verdund zwavelzuur behandelt eerst het bromidezout om Hbr te vormen, en vervolgens KOH om KBr en water te produceren.
Een andere methode om KBr te synthetiseren omvat het laten reageren van broom met een hete oplossing van kaliumhydroxide . Natriumsulfiet reduceert kaliumbromaat en produceert KBr en kaliumbromaat.
Gebruik van kaliumbromide
KBr heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van KBr:
- Fotografie: Wordt veel gebruikt in zwart-witfotografie als fotografisch fixeermiddel om beslaan van fotografisch papier te voorkomen.
- Diergeneeskunde: Gebruikt als anticonvulsief medicijn voor honden en katten die last hebben van epileptische aanvallen.
- Analytische chemie: gebruikt als referentiestandaard bij Fourier Transform Infrared Spectroscopie (FTIR) om organische verbindingen te identificeren.
- Medicinale chemie: Gebruikt bij de bereiding van verschillende farmaceutische producten, waaronder sedativa, hypnotica en anti-epileptica.
- Olieboringen: Gebruikt als voltooiingsvloeistof bij olieboringen om de instroom van formatiewater te voorkomen en het risico op corrosie te verminderen.
- Vlamvertragers: gebruikt als vlamvertragers in kunststoffen, textiel en papierproducten.
- Chemische synthese: Wordt ook gebruikt bij chemische synthesereacties, vooral bij de synthese van verschillende organische en anorganische verbindingen.
Vragen:
Vraag: Onder welke omstandigheden kan kaliumbromide elektriciteit geleiden?
A: KBr kan elektriciteit geleiden in gesmolten toestand of opgelost in water, waardoor de ionen zich vrij kunnen bewegen en een elektrische lading kunnen dragen.
Vraag: Is KBr ionisch of covalent?
A: KBr is een ionische verbinding die wordt gevormd door de overdracht van elektronen van kalium naar broom.
Vraag: Is KBr oplosbaar in water?
A: Ja, KBr is zeer oplosbaar in water, met een oplosbaarheid van 53,5 g/100 ml bij 25°C.
Vraag: Wat is de formule voor kaliumbromide?
A: De chemische formule voor kaliumbromide is KBr.
Vraag: Is KBr een zuur of een base?
A: KBr is een zout en heeft geen zure of basische eigenschappen.
Vraag: Wat is KBr?
A: KBr is het chemische symbool voor kaliumbromide, een ionische verbinding die in verschillende industrieën wordt gebruikt vanwege zijn unieke eigenschappen.
Vraag: Hoeveel massa KBr (in gram) heb je nodig om 250,0 ml van een 1,50 M KBr-oplossing te bereiden?
A: Om een oplossing van 1,50 M KBr in 250,0 ml water te bereiden, moet u 30,4 gram KBr in water oplossen.
