Kaliumbicarbonaat (KHCO3) dient als een wit kristallijn zout, dat veel wordt gebruikt als bakmiddel bij het bakken, als brandblusmiddel en om de zuurgraad van de bodem in de landbouw te neutraliseren. Bovendien fungeert het als voedingssupplement en speelt het een rol bij specifieke medische behandelingen.
| IUPAC-naam | Kaliumwaterstofcarbonaat |
| Moleculaire formule | KHCO3 |
| CAS-nummer | 298-14-6 |
| Synoniemen | Kaliumwaterstofcarbonaat, kaliumzuurzout, kaliumwaterstofcarbonaat, PCN 0775, E501 |
| InChi | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Eigenschappen van kaliumbicarbonaat
Kaliumbicarbonaatformule
De formule voor kaliumbicarbonaat is KHCO3. Deze formule geeft aan dat een kaliumion (K+) wordt gecombineerd met een bicarbonaation (HCO3-) om een kaliumbicarbonaatmolecuul te vormen. De formule is belangrijk in de scheikunde omdat deze informatie geeft over de typen en het aantal atomen waaruit een molecuul bestaat.
Kaliumbicarbonaat molaire massa
KHCO3 heeft een molaire massa van 100,115 g/mol. Dit betekent dat één mol KHCO3 100,115 gram van de verbinding bevat. Molaire massa is een belangrijke eigenschap van een verbinding, omdat deze wordt gebruikt om de hoeveelheid van een stof te berekenen die nodig is voor een chemische reactie. Bovendien kan de molaire massa worden gebruikt om grammen en mollen van een stof om te zetten.
Kookpunt van kaliumbicarbonaat
Het kookpunt van KHCO3 is niet goed gedefinieerd, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt KHCO3 uiteen in kaliumcarbonaat, kooldioxide en water. Daarom wordt de ontledingstemperatuur van KHCO3 gebruikt om de thermische stabiliteit ervan te beschrijven.
Kaliumbicarbonaat smeltpunt
KHCO3 heeft een smeltpunt van 292°C. Bij deze temperatuur verandert KHCO3 van vast in vloeibaar. Het smeltpunt van een verbinding is een belangrijke fysische eigenschap omdat het de omstandigheden bepaalt waaronder de verbinding kan worden gesmolten en verwerkt.
Dichtheid van kaliumbicarbonaat g/ml
De dichtheid van KHCO3 is 2,17 g/ml. Dichtheid is een maat voor de hoeveelheid massa per volume-eenheid. De hoge dichtheid van KHCO3 maakt het een nuttige verbinding in toepassingen zoals brandblussers, waar het wordt gebruikt om branden van klasse B te blussen.
Kaliumbicarbonaat Molecuulgewicht
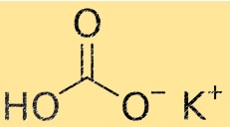
Het molecuulgewicht van KHCO3 is 100,115 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. Deze eigenschap is belangrijk in de scheikunde omdat deze wordt gebruikt om de hoeveelheid van een stof te berekenen die nodig is voor een chemische reactie.
Structuur van kaliumbicarbonaat
KHCO3 heeft een kristalstructuur die lijkt op natriumchloride. De verbinding bestaat uit kaliumionen (K+) en bicarbonaationen (HCO3-). Kaliumionen bezetten de posities van natriumionen in de kristalstructuur van natriumchloride, terwijl bicarbonaationen de posities van chloride-ionen innemen.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2,17 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 100,115 g/mol |
| Dikte | 2,17 g/cm³ |
| Fusie punt | 292°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 25g/100ml (20°C) |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 10,3 (koolzuur) |
| pH | 8,5 – 9,5 (1% oplossing) |
Veiligheid en gevaren van kaliumbicarbonaat
KHCO3 wordt over het algemeen als veilig beschouwd als het wordt gebruikt zoals voorgeschreven. Het kan echter huid- en oogirritatie veroorzaken en moet met zorg worden behandeld. Het kan ook schadelijk zijn als het in grote hoeveelheden wordt ingenomen. Het inademen van stof kan irritatie van de luchtwegen veroorzaken. Bovendien kan het reageren met sterke zuren, waarbij koolstofdioxide vrijkomt, wat gevaarlijk kan zijn. Bij het gebruik van KHCO3 is het belangrijk om veiligheidsprocedures te volgen en geschikte beschermende uitrusting te dragen. Bij inslikken onmiddellijk medische hulp inroepen. In geval van contact met de huid of ogen, het getroffen gebied grondig wassen met water en medische hulp inroepen als de irritatie aanhoudt.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Schadelijk bij inslikken, veroorzaakt huid- en oogirritatie. Vermijd inademing. |
| VN-identificatienummers | VN 2987 |
| HS-code | 2836.30.00 |
| Gevarenklasse | 8 (corrosief) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (rat, oraal): 6.400 mg/kg |
Methoden voor de synthese van kaliumbicarbonaat
In aanwezigheid van water reageert koolstofdioxide met kaliumcarbonaat om KHCO3 te synthetiseren.
De reactie verloopt als volgt:
K2CO3 + CO2 + H2O → 2KHCO3
Een andere methode is om kaliumhydroxide te laten reageren met kooldioxide:
KOH + CO2 → KHCO3
Het resulterende KHCO3 kan vervolgens worden gezuiverd door herkristallisatie uit water. De reactieopbrengst hangt af van de zuiverheid van de grondstoffen en de reactieomstandigheden.
Om KHCO3 te produceren, kan kaliumchloride worden gereageerd met ammoniumbicarbonaat en vervolgens worden behandeld met kooldioxide.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Deze methode heeft het voordeel dat er goedkope grondstoffen worden gebruikt en dat er geen gevaarlijke bijproducten ontstaan.
Gebruik van kaliumbicarbonaat
KHCO3 heeft een breed scala aan toepassingen in verschillende industrieën en toepassingen. Hier zijn enkele van de meest voorkomende toepassingen:
- Voedingsindustrie: Gebruikt als bindmiddel in gebak, zoals cakes, koekjes en brood, om ze te helpen rijzen.
- Landbouw: Gebruikt als fungicide om schimmelplantenziekten, zoals echte meeldauw, te bestrijden.
- Geneesmiddelen: Gebruikt in maagzuurremmers om maagzuur te neutraliseren en indigestie en brandend maagzuur te behandelen.
- Brandblussers: Gebruikt in brandblussers als droog chemisch middel om branden van klasse B en klasse C te blussen.
- Laboratoriumtoepassingen: Gebruikt in diverse laboratoriumtoepassingen, zoals pH-buffering en celcultuur.
- Producten voor persoonlijke verzorging: Gebruikt in tandpasta’s als milde schuurmiddelen en in deodorants om geurtjes onder controle te houden.
- Waterbehandeling: Gebruikt bij waterbehandeling om de pH-waarde aan te passen en zware metalen en andere onzuiverheden te verwijderen.
Vragen:
Vraag: Wat is kaliumbicarbonaat?
A: KHCO3 is een wit, geurloos poeder dat veel wordt gebruikt in verschillende industrieën, zoals de voeding, de landbouw en de farmaceutische industrie. Het heeft de chemische formule KHCO3 en is een zout dat bestaat uit kaliumkation, bicarbonaatanion en watermoleculen.
Vraag: Verandert het bicarbonaat in kaliumbruistabletten in koolstofdioxide?
A: Ja, wanneer kaliumbruistabletten oplossen in water, reageert het bicarbonaat in de tablet met citroenzuur, waarbij kooldioxide vrijkomt. Deze reactie veroorzaakt het karakteristieke bruisen en borrelen dat geassocieerd wordt met bruistabletten.
Vraag: Wat gebeurt er na het toevoegen van kaliumbicarbonaat aan wijn?
HEEFT: Het toevoegen van KHCO3 aan wijn vermindert de zuurgraad van de wijn door te reageren met het overtollige aanwezige zuur. Wijnmakers gebruiken dit proces, ontzuring genoemd, vaak om de smaak en kwaliteit van wijn te verbeteren.
Vraag: Waar kan ik kaliumbicarbonaat kopen?
A: KHCO3 kan worden gekocht bij verschillende chemische leveranciers, online marktplaatsen en winkels voor landbouwbenodigdheden. Het is ook algemeen verkrijgbaar in natuurvoedingswinkels en natuurvoedingsmarkten.
Vraag: Wat is de naam van de verbinding met de formule KHCO3?
A: De verbinding met de formule KHCO3 wordt kaliumbicarbonaat genoemd.
Vraag: Wat werd er tijdens het experiment gedaan om ervoor te zorgen dat alle KHCO3 had gereageerd?
A: In het experiment om er zeker van te zijn dat al het KHCO3 had gereageerd, werd een overmaat zuur aan het reactiemengsel toegevoegd en werd de reactie voortgezet totdat er geen gas meer werd geproduceerd. De afwezigheid van gas gaf aan dat alle KHCO3 met het zuur had gereageerd.
Vraag: Wat gebeurt er als je KHCO3 verwarmt?
A: Wanneer KHCO3 wordt verwarmd, valt het uiteen en vormt kaliumcarbonaat (K2CO3), water en koolstofdioxide. Deze reactie verloopt als volgt: 2KHCO3 → K2CO3 + H2O + CO2.
